Nicht alle Kollisionen Gleich sind
Für ein gas bei Raumtemperatur und Atmosphärendruck etwa 1033 Kollisionen in jedem Kubikzentimeter des Raums jede Sekunde. Wenn jede Kollision zwischen zwei Reaktantenmolekülen Produkte ergeben würde, wären alle Reaktionen in einem Bruchteil einer Sekunde abgeschlossen. Wenn zum Beispiel zwei Billardkugeln kollidieren, springen sie einfach voneinander ab., Dies ist das wahrscheinlichste Ergebnis, wenn die Reaktion zwischen A und B eine signifikante Störung oder Umlagerung der Bindungen zwischen ihren Atomen erfordert. Um eine Reaktion effektiv zu initiieren, müssen Kollisionen ausreichend energetisch sein (oder über ausreichende kinetische Energie verfügen), um diese Bindungsstörung herbeizuführen. Dies wird weiter unten diskutiert.
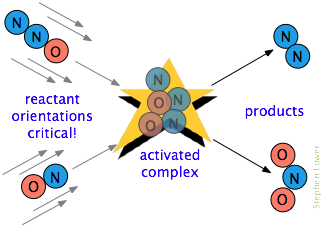
Es ist oft eine zusätzliche Anforderung. Bei vielen Reaktionen, insbesondere solchen mit komplexeren Molekülen, müssen die reagierenden Spezies so ausgerichtet sein, dass sie für den jeweiligen Prozess geeignet sind., Beispielsweise muss bei der Gasphasenreaktion von Dinitrogenoxid mit Stickoxid das Sauerstoffende von N2O das Stickstoffende von NO treffen; Eine Änderung der Orientierung eines der Moleküle verhindert die Reaktion. Aufgrund der umfangreichen Randomisierung molekularer Bewegungen in einem Gas oder einer Flüssigkeit gibt es immer genügend korrekt orientierte Moleküle, auf die einige der Moleküle reagieren können. Je kritischer diese Orientierungsanforderung jedoch ist, desto weniger Kollisionen sind wirksam.,
Energetische Kollisionen zwischen Molekülen führen dazu, dass sich interatomare Bindungen dehnen und biegen, wodurch sie vorübergehend geschwächt werden, so dass sie anfälliger für Spaltung werden. Eine Verzerrung der Bindungen kann ihre zugehörigen Elektronenwolken Wechselwirkungen mit anderen Reaktanten aussetzen, die zur Bildung neuer Bindungen führen können.,
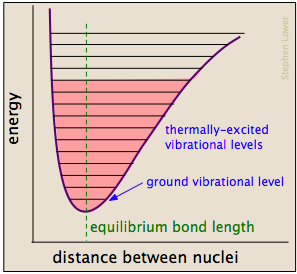
Chemische Bindungen haben einige Eigenschaften mechanischer Federn: Ihre potentiellen Energien hängen davon ab, inwieweit sie gedehnt oder komprimiert sind. Jede Atom-zu-Atom-Bindung kann durch ein potenzielles Energiediagramm beschrieben werden, das zeigt, wie sich ihre Energie mit ihrer Länge ändert., Wenn die Bindung Energie absorbiert (entweder durch Erhitzen oder durch eine Kollision), wird sie in einen höheren quantisierten Schwingungszustand (angezeigt durch die horizontalen Linien) erhöht, der die Bindung schwächt, da ihre Länge zwischen den verlängerten Grenzen oszilliert, die der Kurve entsprechen.
Eine bestimmte Kollision erregt typischerweise eine Reihe von Bindungen auf diese Weise. Innerhalb von etwa 10-13 Sekunden wird diese Anregung auf komplexe und unvorhersehbare Weise auf die anderen Bindungen im Molekül verteilt, die die hinzugefügte Energie an einem besonders anfälligen Punkt konzentrieren können., Die betroffene Bindung kann sich dehnen und weiter biegen, wodurch sie anfälliger für Spaltung ist. Selbst wenn die Bindung nicht durch reine Dehnung bricht, kann sie verzerrt oder verdreht werden, um nahe gelegene Elektronenwolken Wechselwirkungen mit anderen Reaktanten auszusetzen, die eine Reaktion fördern könnten.