Rutherford at Manchester, 1907-1919
Ernest Rutherford entdeckt den Atomkern des atoms in 1911. Wir lesen dies in Lehrbüchern und in populären Schriften. Aber was bedeutet diese Aussage? Geografische Entdeckung bedeutet normalerweise, dass man zum ersten Mal einen Ort sieht. Aber kann Entdeckung für ein Reich, das vor den Augen verborgen ist, dasselbe sein? Man kann kein Atom in diesem Sinne sehen., Dies deutet also darauf hin, dass die Geschichte der Entdeckung des Kerns vielleicht komplizierter war. Die Geschichte, wie sie sich in Rutherfords Labor an der Universität in Manchester entfaltete, drehte sich um echte Menschen. Es ging um Frustrationen und Triumphe. Es ging um harte Arbeit und Ratlosigkeit und Inspiration.
 Als Rutherford 1907 Professor in Manchester wurde, fand er moderne Labore für Lehre und Forschung. Auf Drängen seines Vorgängers Arthur Schuster wurden über 40.000 Pfund gesammelt, um das Physikprogramm auszustatten. Zum Vergleich: Rutherfords großzügiges Gehalt betrug £1,600 / Jahr., Credit: Aus dem Buch: Der physikalischen Laboratorien der University of Manchester: ein Rekord von 25 Jahren Arbeit der University of Manchester, Manchester: At the University Press, 1906. AIP Emilio Segrè Visuelle Archive, Spröde Büchersammlung.
Als Rutherford 1907 Professor in Manchester wurde, fand er moderne Labore für Lehre und Forschung. Auf Drängen seines Vorgängers Arthur Schuster wurden über 40.000 Pfund gesammelt, um das Physikprogramm auszustatten. Zum Vergleich: Rutherfords großzügiges Gehalt betrug £1,600 / Jahr., Credit: Aus dem Buch: Der physikalischen Laboratorien der University of Manchester: ein Rekord von 25 Jahren Arbeit der University of Manchester, Manchester: At the University Press, 1906. AIP Emilio Segrè Visuelle Archive, Spröde Büchersammlung.
Rutherford kam im Sommer 1907, Monate vor Beginn der Universitätszeit, nach Manchester. Er wurde zum Langworthy Professor of Physics ernannt, Nachfolger von Arthur Schuster (1851-1934), der im Alter von 56 Jahren in den Ruhestand ging, um Rutherford zu rekrutieren. Schuster hatte ein modernes Physik-Gebäude gebaut, Hans Geiger, Ph. D., (1882-1945) wegen seiner experimentellen Fähigkeiten und stiftete eine neue Position in der mathematischen Physik, um ein vollständiges Physikprogramm abzurunden. Rutherford betrat das Zentrum der Physikwelt. Forscher kamen Dutzend für Dutzend zu ihm.
Rutherford kam mit vielen Forschungsfragen im Auge. Er war nicht mit den Rätseln der Zerfallsfamilien Thorium, Radium usw. fertig. aber er gab viel von dieser Arbeit an Boltwood, Hahn und Soddy weiter. Boltwood und Hahn arbeiteten beide mit Rutherford in Manchester, Boltwood in 1909-1910 und Hahn in 1907-1908., Rutherford wandte seine Aufmerksamkeit allmählich viel mehr auf die α (alpha) -, β (beta) – und γ (Gamma) – Strahlen selbst und auf das, was sie über das Atom enthüllen könnten. Das heißt, er überließ Radiochemie anderen und wandte sich der Physik zu.
 Rutherford versammelte immer eine Gruppe kluger junger Forscher um ihn herum. In diesem Gruppenfoto von 1910 sind Ernest Marsden und Hans Geiger. Vorne und in der Mitte befinden sich die Professoren Schuster und Rutherford, und hinten befindet sich William Kay, der talentierte und hilfsbereite Laborverwalter. Kredit: J. B. Birks, ed.,, Rutherford at Manchester (London: Heywood & Co., 1962), gegenüber S. 38.
Rutherford versammelte immer eine Gruppe kluger junger Forscher um ihn herum. In diesem Gruppenfoto von 1910 sind Ernest Marsden und Hans Geiger. Vorne und in der Mitte befinden sich die Professoren Schuster und Rutherford, und hinten befindet sich William Kay, der talentierte und hilfsbereite Laborverwalter. Kredit: J. B. Birks, ed.,, Rutherford at Manchester (London: Heywood & Co., 1962), gegenüber S. 38.
Rutherfords frühe Mitarbeiter in Manchester waren Geiger und William Kay (1879-1961), Junior laboratory Assistant seit 1894. Rutherford beförderte Kay 1908 zum Laboratory Steward, um Laborgeräte zu verwalten und ihm bei seiner Forschung zu helfen. 1957 dachte Kay in einem Interview an seine Jugend mit Rutherford zurück. Die Sprache ist malerisch, aber die Beschreibung ist so nah an Rutherfords Ansatz, wie wir bekommen., Der Fragesteller war Samuel Devons (1914-2006), einer der letzten Studenten Rutherfords in den 1930er Jahren.
 Hans Geiger war von 1907 bis 1913 Rutherfords Hauptpartner in der Alpha-Ray-Forschung. Zusammen entwickelten sie mehrere Möglichkeiten, Alpha-Strahlen zu erkennen. Sie bewiesen, dass Alpha-Strahlen doppelt ionisierte Heliumkerne sind. Ca. 1908. Kredit: AIP Emilio Segre Visual Archives, Physik heute Sammlung.
Hans Geiger war von 1907 bis 1913 Rutherfords Hauptpartner in der Alpha-Ray-Forschung. Zusammen entwickelten sie mehrere Möglichkeiten, Alpha-Strahlen zu erkennen. Sie bewiesen, dass Alpha-Strahlen doppelt ionisierte Heliumkerne sind. Ca. 1908. Kredit: AIP Emilio Segre Visual Archives, Physik heute Sammlung.
Rutherford und Hans Geiger arbeiteten 1907 und 1908 eng an der Detektion und Messung von α-Teilchen., Wenn sie α-Teilchen verwenden würden, um das Atom zu untersuchen, müssten sie zuerst mehr über diese Teilchen und ihr Verhalten wissen. Rutherford hatte bei McGill versucht und versagt, α-Partikel zu zählen.
Ein Jahr später gelang es ihm und Geiger in Manchester mit zwei Methoden, α-Teilchen zu beobachten. Die erste Methode umfasste Szintillationen, die durch α-Partikel auf einer dünnen Schicht Zinksulfid angeregt wurden. Sie beobachteten diese durch ein Mikroskop und zählten die Szintillationen in verschiedenen Dispersionswinkeln., Sie entwickelten auch ein“ Elektrometer“, das einem großen Publikum den Durchgang eines einzelnen α-Partikels demonstrieren konnte. Das Instrument, das sich zum „Geigerzähler“ entwickelte, hatte einen teilweise evakuierten Metallzylinder mit einem Draht in der Mitte. Sie legten eine Spannung zwischen dem Zylinder und dem Draht an, die hoch genug war, um fast zu funken. Sie nahmen α-Partikel durch ein dünnes Glimmerfenster auf, wo diese Partikel mit Gasen kollidierten und Gasionen produzierten. Diese kollidierten dann mit anderen Molekülen und produzierten mehr Ionen und so weiter., Jedes α-Teilchen erzeugte eine Kaskade von Ionen, die den Zylinder teilweise abgaben und den Durchgang eines α-Teilchens anzeigten. Geiger und Rutherford veröffentlichten 1908 und 1909 mehrere Artikel über diese Methoden und ihre Verwendung.Juli 1908 schrieb Rutherford an Henry Bumstead (1870-1920), einen amerikanischen Physiker:
Geiger ist ein guter Mann und arbeitete wie ein Sklave. Ich hätte nie Zeit für die Drudgery finden können, bevor wir die Dinge in gutem Stil in Gang gebracht haben. Schließlich ging alles gut, aber die Streuung ist der Teufel. Unsere Röhre funktionierte wie ein Zauber und wir konnten leicht einen Wurf von 50 mm bekommen., für jedes Teilchen. … Geiger ist ein Dämon bei der Arbeit, Szintillationen zu zählen, und konnte eine ganze Nacht lang in Intervallen zählen, ohne seinen Gleichmut zu stören. Ich habe mich nach zwei Minuten energisch zurückgezogen. (Zitiert in Eve, S. 180.)
Obwohl Rutherford bereits 1906 vermutete, dass α-Teilchen Heliumatome waren, die von ihren Elektronen befreit waren, verlangte er einen hohen Beweisstandard. Eine Art Experiment war nicht genug. Eine Art Detektor war nicht genug. Er wollte mehr Beweise., Dafür wünschte Rutherford“ große Spannungen “ und große Elektromagnete, um α-Partikel abzulenken, aber diese Methode war noch nicht reif. Lab Steward William Kay erinnerte sich im zitierten Oral History Interview daran, dass Rutherford 1908 darauf bestand, dass starke elektrische und magnetische Felder benötigt würden, um die Ladung und Masse der α-und β-Teilchen direkter zu messen:
Kay sagte, Rutherford wolle einen großen, wassergekühlten Magneten, aber dass er ihn „wie einen heißen Kuchen fallen ließ“, als er seine Kosten erfuhr. Also brauchte er eine neue Angriffslinie. Die neue Linie war sehr einfach, ein chemisches Verfahren gemischt mit Physik., Für diese Arbeit rekrutierte Rutherford Thomas Royds (1884-1955), der 1906 sein Physics Honours Degree erworben hatte. Sie sammelten α-Partikel in einem versiegelten Glasrohr, komprimierten sie und ließen einen elektrischen Funken durch. Sie untersuchten das emittierte Licht in einem Spektroskop und fanden es identisch mit dem Helium-Spektrum. Innerhalb weniger Monate erhielt Rutherford den Nobelpreis für Chemie „für seine Untersuchungen zum Zerfall der Elemente und zur Chemie radioaktiver Substanzen.,“(Nobel-Zitat), die Rutherford und Royds errichtet hatte, die Identität und die primären Eigenschaften von α-Teilchen. Rutherford wandte sich als nächstes seiner Aufmerksamkeit zu, sie zu benutzen, um das Atom zu untersuchen.
Im Herbst 1908 begann eine wichtige Forschungsreihe. Geiger hatte Strahlen von α-Teilchen durch Gold und andere metallische Folien geleitet und dabei die neuen Nachweistechniken verwendet, um zu messen, wie stark diese Strahlen von den Atomen in den Folien dispergiert wurden. Geiger dachte Ernest Marsden (1889-1970), ein 19-jähriger Student in Ehrenphysik, war bereit, bei diesen Experimenten zu helfen und schlug es Rutherford vor., Da Rutherford Studenten im dritten Jahr oft in die Forschung drängte und sagte, dies sei der beste Weg, um etwas über Physik zu lernen, stimmte er bereitwillig zu.
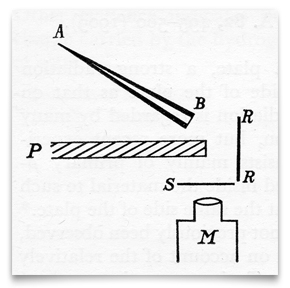 Diese Skizze aus dem Artikel von Geiger und Marsden aus dem Jahr 1909 zeigt eine konische Glasröhre voller“ Radiumemanation “ (Radon), die bei B mit einer dünnen Glimmerscheibe verschlossen ist. Dies war ihre Quelle von Alpha (α) – Teilchen. S war ein Zink-Sulfid-Sieb, das beim Auftreffen auf ein α-Teilchen funkelte. P war ein Bleisieb, das jegliche α-Partikel daran hinderte, direkt zum Zink-Sulfid-Sieb zu gelangen., RR war eine Folie (oder Folien) aus verschiedenen Metallen (einschließlich Gold), die einfallende α-Partikel „diffus reflektierte“. Geiger und Marsden beobachtet die resultierende szintillationen durch ein Mikroskop beobachten, M. Credit: H. Geiger und E. Marsden, „Auf eine Diffuse Reflexion der α-Teilchen,“ Proceedings of the Royal Society,1909, 82:495-500.
Diese Skizze aus dem Artikel von Geiger und Marsden aus dem Jahr 1909 zeigt eine konische Glasröhre voller“ Radiumemanation “ (Radon), die bei B mit einer dünnen Glimmerscheibe verschlossen ist. Dies war ihre Quelle von Alpha (α) – Teilchen. S war ein Zink-Sulfid-Sieb, das beim Auftreffen auf ein α-Teilchen funkelte. P war ein Bleisieb, das jegliche α-Partikel daran hinderte, direkt zum Zink-Sulfid-Sieb zu gelangen., RR war eine Folie (oder Folien) aus verschiedenen Metallen (einschließlich Gold), die einfallende α-Partikel „diffus reflektierte“. Geiger und Marsden beobachtet die resultierende szintillationen durch ein Mikroskop beobachten, M. Credit: H. Geiger und E. Marsden, „Auf eine Diffuse Reflexion der α-Teilchen,“ Proceedings of the Royal Society,1909, 82:495-500.
Geiger und Marsden begannen mit der kleinen Winkeldispersion und versuchten verschiedene Foliendicken, wobei sie mathematische Beziehungen zwischen Dispersion und Foliendicke oder Anzahl der durchquerten Atome suchten., Marsden erinnerte sich später daran, dass Rutherford inmitten dieser Experimente zu ihm sagte: „Sehen Sie, ob Sie einen Effekt von Alphateilchen erzielen können, die direkt von einer Metalloberfläche reflektiert werden.“(Berichtet von Marsden in Birks, 1962, S. 8). Marsden bezweifelte, dass Rutherford eine Streuung von α-Teilchen erwartete, aber wie Marsden schrieb
…war es eine dieser „Vermutungen“, dass vielleicht ein Effekt beobachtet werden könnte und dass auf jeden Fall das benachbarte Gebiet dieses Tom Tiddler ’s Bodens durch Aufklärung erforscht werden könnte., Rutherford war immer bereit, das Unerwartete zu treffen und es auszunutzen, wo möglich, aber er wusste auch, wann er auf solchen Ausflügen anhalten sollte. (Birks, 1962, S. 8)
Dies war Rutherfords spielerische Herangehensweise in Aktion. Seine Schüler und andere probierten seine Ideen aus, von denen viele Sackgassen waren. Diese Idee, nach Rückstreuung von α-Teilchen zu suchen, zahlte sich jedoch aus., Rutherford schrieb:
Experiment, geleitet von der disziplinierte Phantasie, entweder eines einzelnen oder, noch besser, von einer Gruppe von Individuen der verschiedensten psychischen outlook ist in der Lage, Ergebnisse zu erzielen, die weit über die Vorstellungskraft allein der größte Philosoph. (Zitiert in Eve, 1939, Frontmatter)
Irgendwann später in 1908 oder 1909, sagte Marsden, berichtete er Rutherford seine Ergebnisse. Rutherford erinnerte sich ein wenig anders:
Ich erinnere mich …später kam Geiger in großer Aufregung zu mir und sagte: „Wir konnten einige der α-Teilchen rückwärts kommen lassen…,“Es war das unglaublichste Ereignis, das mir jemals in meinem Leben passiert ist. Es war fast unglaublich, als hättest du eine 15-Zoll-Granate auf ein Stück Seidenpapier abgefeuert und es kam zurück und traf dich. (Rutherford, 1938, S. 68)
Das menschliche Gedächtnis ist fehlbar. Ob Marsden oder Geiger sagte Rutherford, der Effekt war der gleiche. Rutherford sagte, sie sollten eine Veröffentlichung aus dieser Forschung vorbereiten, die sie im Mai 1909 vorlegten. Außerdem, dies begann Rutherford zu denken, was letztlich, fast zwei Jahre später, veröffentlichte er als Theorie des Atoms.,
Was hat Rutherford für den Rest von 1909 und 1910 getan? Zum einen war sein enger Freund Boltwood für das akademische Jahr in Manchester und arbeitete mit Rutherford an radioaktiven Zerfallsprodukten von Radium. Er überprüfte und sprach auch über frühere Ideen zur atomaren Struktur. Am wichtigsten war, dass er das Phänomen der Streuung von α-Partikeln systematisch auseinander nahm und jedes Stück testete. Rutherford hatte seine kühne Idee — das Kernatom — nicht sofort, aber er kam allmählich dazu, indem er das Problem von vielen Seiten betrachtete.,
Im Herbst 1910 brachte er Marsden zurück nach Manchester, um seine Ideen mit Geiger rigoros zu testen. Sie stellten die Emissionsraten und die Bereiche der α-Partikel durch radioaktive Quellen wieder her und untersuchten ihre statistischen Analysen erneut. Rutherford versuchte, die Streuergebnisse mit verschiedenen Atommodellen in Einklang zu bringen, insbesondere mit denen von J. J. Thomson, bei denen die positive Elektrizität als gleichmäßig über die gesamte Sphäre des Atoms verteilt angesehen wurde.
 Eine Seite von Rutherford Anfang, undatiert (1910 oder 1911), rough notes., Die ersten Zeilen lesen: „Theorie der Struktur des Atoms. Angenommen, Atom besteht aus + Ladung ne in der Mitte & of – charge als Elektron verteilt über Kugel des Radius r. “ Er rauhte dann Ideen über die Berechnung der Kraft der Ablenkung auf ein geladenes Teilchen vorbei in der Nähe dieses geladenen Zentrums. Kredit: J. B. Birks, ed., Rutherford at Manchester (London: Heywood & Co., 1962), S. 70.
Eine Seite von Rutherford Anfang, undatiert (1910 oder 1911), rough notes., Die ersten Zeilen lesen: „Theorie der Struktur des Atoms. Angenommen, Atom besteht aus + Ladung ne in der Mitte & of – charge als Elektron verteilt über Kugel des Radius r. “ Er rauhte dann Ideen über die Berechnung der Kraft der Ablenkung auf ein geladenes Teilchen vorbei in der Nähe dieses geladenen Zentrums. Kredit: J. B. Birks, ed., Rutherford at Manchester (London: Heywood & Co., 1962), S. 70.
Irgendwann im Winter 1910-1911 erarbeitete Rutherford die Grundidee eines Atoms mit einem „geladenen Zentrum“.,“Wie Geiger und Marsden in ihrem Artikel von 1909 betonten:
Wenn die hohe Geschwindigkeit und Masse des α-Teilchens berücksichtigt werden, erscheint es überraschend, dass einige der α-Teilchen, wie das Experiment zeigt, innerhalb einer Schicht von 6 x 10-5 cm gedreht werden können. von Gold durch einen Winkel von 90° und noch mehr. Um einen ähnlichen Effekt durch ein Magnetfeld zu erzeugen, wäre das enorme Feld von 109 absoluten Einheiten erforderlich. (Birks, p., 179)
Rutherford kam in seinem Papier vom Mai 1911 zu dem Schluss, dass eine so bemerkenswerte Abweichung auf dem Weg eines massiv geladenen Teilchens nur erreicht werden konnte, wenn der größte Teil der Masse beispielsweise eines Goldatoms und der größte Teil seiner Ladung in einem sehr kleinen Zentralkörper konzentriert waren. Hinweis: Zu diesem Zeitpunkt im Jahr 1911 nannte Rutherford dies nicht „Kern“.“
Sie benötigen Flash Player installiert, um diesen Audio-Clip zu hören.,
Die erste öffentliche Ankündigung der Nukleartheorie von Rutherford wurde auf einem Treffen der Manchester Literary and Philosophical Society gemacht, und er lud uns Young Boys ein, zu dem Treffen zu gehen. Er sagte, er hätte einige interessante Dinge zu sagen und er dachte, wir würden sie gerne hören. Wir wussten damals nicht, worum es ging. Die älteren Leute im Labor wussten es natürlich, Geiger und Marsden wussten es, weil sie die Experimente bereits durchführten. In der Tat, es sei denn, sie hatten einige getan, die ausreichten, um entscheidend zu sein, Rutherford erwähnte es nie öffentlich., Und natürlich wusste Darwin viel früher davon. Aber das muss früh im Jahr 1911 gewesen sein, und wir gingen zu dem Treffen und er sagte es uns. Und er erwähnte dann, dass es einige experimentelle Beweise gab, die von Geiger und Marsden erhalten worden waren. Er hat, soweit ich mich erinnere, nicht mehr über die Ergebnisse gesagt, als dass sie ziemlich entscheidend waren. Und wie ich schon sagte, hätte er niemals eine solche öffentliche Ankündigung gemacht, wenn er keine guten Beweise gehabt hätte., Und das ist eines der Merkmale, die alle Rutherfords Arbeiten durchlaufen, insbesondere alle seine Arbeiten bis zum Ende der Manchester-Periode. Wenn Sie sich einige seiner Papiere in den frühen Tagen ansehen — ich nenne McGill die frühen Tage -, war er ziemlich überzeugt, dass die Alphateilchen Atome von Helium waren, aber er sagte das nie in diesen Worten. Er sagte immer, sie seien entweder Atome von Helium oder Moleküle von Wasserstoff oder vielleicht hat er etwas anderes von diesem Gewicht gesagt., Es war ziemlich charakteristisch für ihn, dass er niemals sagen würde, dass etwas so war, es sei denn, er hatte experimentelle Beweise dafür, die ihn wirklich zufrieden stellten.
Tatsächlich war Rutherford äußerst vorsichtig, wenn es Rückschlüsse auf diese zentrale Ladung zog: „Eine einfache Berechnung zeigt, dass das Atom ein Sitz eines intensiven elektrischen Feldes sein muss, um eine so große Deflexion bei einer einzigen Begegnung zu erzeugen.“(Birks, S. 183). Er arbeitete schnell und grob heraus, dass mehrere quantitative Beziehungen wahr sein sollten, wenn diese grundlegende Theorie korrekt wäre., Erstens sollte die Anzahl der α-Partikel, die durch einen bestimmten Winkel gestreut sind, proportional zur Dicke der Folie sein. Zweitens sollte diese Zahl proportional zum Quadrat der Kernladung sein. Schließlich sollte es umgekehrt proportional zur vierten Potenz der Geschwindigkeit des α-Teilchens sein. Diese drei Ideen legten das experimentelle Programm von Geiger und Marsden für das nächste Jahr fest.
Sie benötigen einen installierten Flash Player, um diesen Audioclip anzuhören.,
Rutherfords Interesse galt damals fast ausschließlich der Forschung. Er hatte sehr wenig Unterricht in McGill gemacht. Er war Forschungsprofessor. Ich nehme an, er hielt einige Vorträge, aber es wären sehr wenige gewesen. Und sein Interesse war ganz natürlich auf der Forschungsseite. Er hielt einige Vorlesungen, aber elementare Vorlesungen, so etwas würde man von einem Mann erwarten, bevor er an die Universität kam. Sie waren die Vorlesungen an die Ingenieure. Sie waren ein rowdy viel und Rutherford konnte sie unter Kontrolle halten., Es gab vielleicht nur einen anderen Mann in der Abteilung, der es hätte tun können ,und er (Rutherford? er genoss sie, weil er ihnen die sehr interessanten Experimente zeigen konnte, die man in Grundkursen durchführen kann.
Es wurde mir oft gesagt, dass Rutherford ein schlechter Dozent war. Ich habe noch nie solchen Unsinn gehört. Es ist ganz richtig, dass er gelegentlich ein bisschen langweilig wäre, ein bisschen durcheinander, aber das war nur sehr selten. Es gab andere Gelegenheiten, bei denen er wirklich am anregendsten war. Es gab eine enorme Begeisterung über ihn.,
Rutherford unterhielt die Möglichkeit, dass das geladene Zentrum negativ ist. Das klingt heute seltsam, also was hat es vernünftig gemacht? Erstens unterschied es sich nicht sehr von Thomsons Modell. Zweitens, da Rutherford wusste, dass α-Teilchen eine doppelte + Ladung tragen, dachte er, dies könnte sich genauso verhalten wie die Sonne auf einem nahe gelegenen Kometen. Es würde das α-Teilchen um und zurück zu seiner Quelle schleudern. Er betrachtete auch ein fast vergessenes Modell, das der japanische Physiker Hantaro Nagaoka (1865-1950) vorgeschlagen hatte — das saturnische Modell., Nagaoka und Rutherford standen 1910 und 1911 in Kontakt und Rutherford erwähnte Nagaokas Modell einer „zentralen Anziehungsmasse, die von Ringen rotierender Elektronen umgeben ist“ (Birks, P. 203). Das Endergebnis in diesem kritischen Rutherford-Papier war jedoch Rutherfords Ankündigung, dass, ob das Atom eine Scheibe oder eine Kugel war und ob die Zentralladung positiv oder negativ war, die Berechnungen nicht beeinflussen würde. Rutherford achtete immer darauf, nicht mehr zu beanspruchen, als seine Ergebnisse unterstützen konnten.,
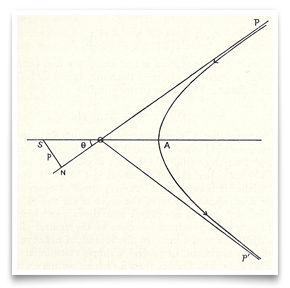 In Rutherfords berühmtem Papier vom Mai 1911 über die Streuung von Alphateilchen durch Goldfolie hat er diese Skizze des hyperbolischen Weges eines Teilchens aufgenommen. Credit: E. Rutherford,“ Die Streuung von α-und β-Teilchen durch Materie und die Struktur der Materie“, Philosophical Magazine, 1911, 21:669-688.
In Rutherfords berühmtem Papier vom Mai 1911 über die Streuung von Alphateilchen durch Goldfolie hat er diese Skizze des hyperbolischen Weges eines Teilchens aufgenommen. Credit: E. Rutherford,“ Die Streuung von α-und β-Teilchen durch Materie und die Struktur der Materie“, Philosophical Magazine, 1911, 21:669-688.
Rutherford hat mögliche Tests der Art der zentralen Ladung gesehen. Die Absorption von β-Partikeln sollte bei einem negativen Zentrum anders sein als bei einem positiven., Ein positives Zentrum würde die große Geschwindigkeit erklären, die α-Partikel während der Emission radioaktiver Elemente erreichen. Aber das waren nur Hinweise.
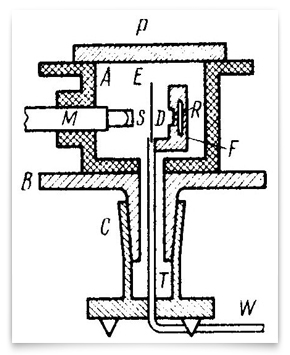 Dieses Schema stellt die verfeinerten Experimente von 1912-13 dar, die von Geiger und Marsden durchgeführt wurden. R war die Quelle der Alphateilchen, E war die Goldfolie, und M war das Mikroskop drehbar um eine vertikale Achse zentriert auf der Goldfolie. Alphateilchen von der Quelle durchquerten die Membran D, wurden von der Folie gestreut und wurden als Szintillationen auf dem Bildschirm S beobachtet., Geiger und Marsden beobachteten die Winkel der gestreuten Teilchen durch Drehen der Mikroskop-Bildschirmanordnung. Credit: H. Geiger und E. Marsden, „Die Gesetze der Deflexion von α-Teilchen durch große Winkel“, Philosophische Zeitschrift, 1913, 25:604-623.
Dieses Schema stellt die verfeinerten Experimente von 1912-13 dar, die von Geiger und Marsden durchgeführt wurden. R war die Quelle der Alphateilchen, E war die Goldfolie, und M war das Mikroskop drehbar um eine vertikale Achse zentriert auf der Goldfolie. Alphateilchen von der Quelle durchquerten die Membran D, wurden von der Folie gestreut und wurden als Szintillationen auf dem Bildschirm S beobachtet., Geiger und Marsden beobachteten die Winkel der gestreuten Teilchen durch Drehen der Mikroskop-Bildschirmanordnung. Credit: H. Geiger und E. Marsden, „Die Gesetze der Deflexion von α-Teilchen durch große Winkel“, Philosophische Zeitschrift, 1913, 25:604-623.
Geiger und Marsden in der Tat arbeiten systematisch durch die testbaren Implikationen von Rutherford das zentrale Ladung Hypothese. Die erste große Veröffentlichung ihrer Ergebnisse fand 1912 in den Sitzungsberichten der Wiener Akademie der Wissenschaften statt., Auf diese 30-seitige Version folgte 1913 eine in englischer Sprache in der Philosophischen Zeitschrift:“ Die Gesetze der Deflexion von α-Teilchen durch große Winkel “ Die englische Version ist die bekanntere. Leichte Unterschiede zwischen den beiden führten dazu, dass ein Historiker darauf hindeutete, dass Rutherford sich im August 1912 für ein positiv geladenes Zentrum entschied (Trenn, 1974). Rutherfords andere Teammitglieder, insbesondere Charles Galton Darwin (1887-1962), H. G. J. Moseley (1887-1915) und Niels Bohr (1885-1962), spielten eine wichtige Rolle bei der endgültigen Etablierung von Rutherfords Kernatom.,
 Der junge Henry G. J. Moseley, in der Balliol-Trinity Laboratory, Oxford, ca. 1910. Später in diesem Jahr begann Moseley in Rutherfords Manchester Lab zu forschen. Credit: University of Oxford, Museum of the History of Science, courtesy AIP Emilio Segrè Visual Archives, Physics Today Collection.
Der junge Henry G. J. Moseley, in der Balliol-Trinity Laboratory, Oxford, ca. 1910. Später in diesem Jahr begann Moseley in Rutherfords Manchester Lab zu forschen. Credit: University of Oxford, Museum of the History of Science, courtesy AIP Emilio Segrè Visual Archives, Physics Today Collection.
Der „Große Krieg“ völlig gestört work in Rutherford ‚ s Manchester-Abteilung. Bohr kehrte nach Dänemark zurück. Marsden nahm eine Professur in Neuseeland an. Moseley starb in der Schlacht von Gallipoli., James Chadwick (1891-1974), der mit Geiger an der Technischen Universität Berlin arbeitete, als der Krieg ausbrach, verbrachte mehrere Jahre im Lager Ruhleben für Kriegsgefangene. Auch andere Studenten zogen in den Krieg, und Rutherford widmete beträchtliche Energie der Mobilisierung der Wissenschaft für die Kriegsanstrengungen und speziell der U-Boot-Abwehrtechniken.
 Niels Bohr arbeitete erstmals 1912 bei Rutherford in Manchester. Dieses Foto zeigt die jungen Niels und Margrethe Bohr, ca., 1914, als Bohr die Nachfolge von Charles Galton Darwin als Schuster-Leser in der Mathematischen Physik in Manchester antrat. Kredit: AIP Emilio Segre Visuelle Archive, Margrethe Bohr Sammlung.Vor diesem Hintergrund begannen Rutherford und sein Laborleiter William Kay 1917, den Durchgang von α-Teilchen durch Wasserstoff, Stickstoff und andere Gase zu untersuchen. Als der Große Krieg endete, half Ernest Marsden kurz mit den langwierigen Szintillationsbeobachtungen, die Hinweise auf die Natur des Kerns lieferten. Rutherford berichtete über die vorläufigen Ergebnisse dieser umfangreichen Experimente im Jahr 1919., Rutherford stellte eine Quelle von Radium C (Wismut-214) in einen verschließbaren Messingbehälter, der so angebracht war, dass die Position der Quelle geändert werden konnte und so verschiedene Gase eingeführt oder ein Vakuum erzeugt werden konnten, wie gewünscht. Die α-Partikel durchquerten das Innere des Behälters und durchquerten einen Schlitz, der von einer Silberplatte oder einem anderen Material bedeckt war, und trafen auf ein Zinksulfid-Sieb, wo eine Szintillation in einem abgedunkelten Raum beobachtet wurde. Als Wasserstoffgas in den Behälter eingeführt wurde und darauf geachtet wurde, die α-Partikel zu absorbieren, bevor sie auf den Bildschirm trafen, wurden immer noch Szintillationen beobachtet., Rutherford vermutete, dass die α-Teilchen, als sie das Wasserstoffgas durchquerten, gelegentlich mit Wasserstoffkernen kollidierten. Wie Rutherford schrieb, erzeugte dies „schnelle Wasserstoffatome“, die größtenteils in Richtung der ursprünglichen Bewegung der α-Teilchen nach vorne projiziert wurden.
Niels Bohr arbeitete erstmals 1912 bei Rutherford in Manchester. Dieses Foto zeigt die jungen Niels und Margrethe Bohr, ca., 1914, als Bohr die Nachfolge von Charles Galton Darwin als Schuster-Leser in der Mathematischen Physik in Manchester antrat. Kredit: AIP Emilio Segre Visuelle Archive, Margrethe Bohr Sammlung.Vor diesem Hintergrund begannen Rutherford und sein Laborleiter William Kay 1917, den Durchgang von α-Teilchen durch Wasserstoff, Stickstoff und andere Gase zu untersuchen. Als der Große Krieg endete, half Ernest Marsden kurz mit den langwierigen Szintillationsbeobachtungen, die Hinweise auf die Natur des Kerns lieferten. Rutherford berichtete über die vorläufigen Ergebnisse dieser umfangreichen Experimente im Jahr 1919., Rutherford stellte eine Quelle von Radium C (Wismut-214) in einen verschließbaren Messingbehälter, der so angebracht war, dass die Position der Quelle geändert werden konnte und so verschiedene Gase eingeführt oder ein Vakuum erzeugt werden konnten, wie gewünscht. Die α-Partikel durchquerten das Innere des Behälters und durchquerten einen Schlitz, der von einer Silberplatte oder einem anderen Material bedeckt war, und trafen auf ein Zinksulfid-Sieb, wo eine Szintillation in einem abgedunkelten Raum beobachtet wurde. Als Wasserstoffgas in den Behälter eingeführt wurde und darauf geachtet wurde, die α-Partikel zu absorbieren, bevor sie auf den Bildschirm trafen, wurden immer noch Szintillationen beobachtet., Rutherford vermutete, dass die α-Teilchen, als sie das Wasserstoffgas durchquerten, gelegentlich mit Wasserstoffkernen kollidierten. Wie Rutherford schrieb, erzeugte dies „schnelle Wasserstoffatome“, die größtenteils in Richtung der ursprünglichen Bewegung der α-Teilchen nach vorne projiziert wurden.
Rutherford hatte während dieser Experimente mehrere subtile Fragen im Sinn, die sich hauptsächlich mit der Natur des Kerns befassten., Er bat seinen Kollegen Darwin, diese Kollisionen auf der Grundlage einer „einfachen Theorie“ von elastischen Kollisionen zwischen Punktkernen zu analysieren, die nach einem inversen Quadratgesetz abgestoßen wurden, wobei die α-Teilchen eine Ladung von 2 mal der eines Elektrons (und des entgegengesetzten Vorzeichens) und der Wasserstoffkerne 1 mal tragen. Darwin fand heraus, dass alle α-Teilchen, die sich innerhalb von 2, 4×10-13 cm nähern, ein „schnelles Wasserstoffatom“ erzeugen würden.“Diese einfache Theorie sagte jedoch weit weniger beschleunigte Wasserstoffatome voraus, als in den Experimenten beobachtet wurden.,
Rutherford lehnte Erklärungen dieser Varianz ab, die auf unterschiedlichen Ladungen auf den Teilchen oder anderen Gesetzen als den inversen Quadratgesetzen beruhten. Vielmehr kam er zu dem Schluss, dass für Entfernungen in der Größenordnung des Durchmessers des Elektrons “ die Struktur des Heliumkerns nicht mehr als Punkt angesehen werden kann…“. Er vermutete, dass der Heliumkern (α-Teilchen) eine komplexe Struktur von vier Wasserstoffkernen plus zwei negativ geladenen Elektronen hat. (Wir würden sagen, es besteht aus zwei Protonen.,) Rutherford Schluss, dass die Verformung der komplexen Kernen bei Kollisionen war eine wahrscheinlichere Erklärung, die variation der Kräfte zwischen den Kernen unterschiedlicher komplexer Weise auf die Annäherung.
Unter Berücksichtigung der intensiven Kräfte, die bei solchen Kollisionen zum Tragen kommen, wäre es nicht verwunderlich, wenn der Heliumkern zerbrechen würde. Es wurden keine Anzeichen für einen solchen Zerfall beobachtet, was darauf hindeutet, dass der Heliumkern eine sehr stabile Struktur haben muss.,
Wir müssen uns daran erinnern, dass Rutherford die Struktur des Kerns nicht direkt beobachten konnte, daher waren seine Schlussfolgerungen vorläufig. Trotzdem überlegte er offen über die Möglichkeiten eines komplexen Kerns, der verformbar und sogar zerfallen kann. Diese Gedanken prägten diese intensive Zeit experimenteller Forschungen.