Elektronenkonfiguration
Die Elektronen in einem Atom füllen ihre Atomorbitale nach dem Aufbauprinzip; „Aufbau“ bedeutet auf Deutsch „Aufbau“.“Das Aufbau-Prinzip, das das Pauli-Ausschlussprinzip und die Hund-Regel enthält, schreibt einige einfache Regeln vor, um die Reihenfolge zu bestimmen, in der Elektronen Atomorbitale füllen:
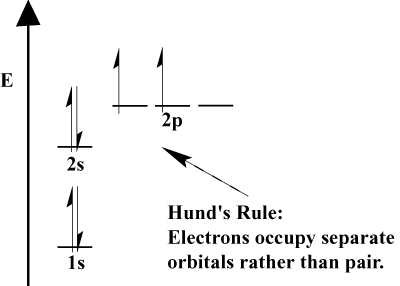
- Elektronen füllen immer zuerst Orbitale niedrigerer Energie. 1s wird vor 2s und 2s vor 2p gefüllt.,
- Das Pauli-Ausschlussprinzip besagt, dass keine zwei Elektronen innerhalb eines bestimmten Atoms identische Quantenzahlen haben können. In der Funktion bedeutet dieses Prinzip, dass, wenn zwei Elektronen das gleiche Orbital einnehmen, sie einen entgegengesetzten Spin haben müssen.
- Die Regel von Hund besagt, dass ein Elektron, wenn es sich einem Atom anschließt und zwischen zwei oder mehr Orbitalen derselben Energie wählen muss, es vorzieht, in ein leeres Orbital einzutreten, anstatt in ein bereits besetztes., Wenn dem Atom mehr Elektronen hinzugefügt werden, neigen diese Elektronen dazu, Orbitale derselben Energie zur Hälfte zu füllen, bevor sie sich mit vorhandenen Elektronen paaren, um Orbitale zu füllen.
Valenz-und Valenzelektronen
Die äußerste Orbitalschale eines Atoms wird Valenzschale genannt, und die Elektronen in der Valenzschale sind Valenzelektronen. Valenzelektronen sind die Elektronen mit der höchsten Energie in einem Atom und daher die reaktivsten. Während innere Elektronen (die sich nicht in der Valenzhülle befinden) typischerweise nicht an chemischen Bindungen und Reaktionen teilnehmen, können Valenzelektronen gewonnen, verloren oder geteilt werden, um chemische Bindungen zu bilden., Aus diesem Grund neigen Elemente mit der gleichen Anzahl von Valenzelektronen dazu, ähnliche chemische Eigenschaften zu haben, da sie dazu neigen, Valenzelektronen auf die gleiche Weise zu gewinnen, zu verlieren oder zu teilen. Das Periodensystem wurde mit dieser Funktion konzipiert. Jedes Element hat eine Anzahl von Valenzelektronen, die seiner Gruppennummer im Periodensystem entspricht.
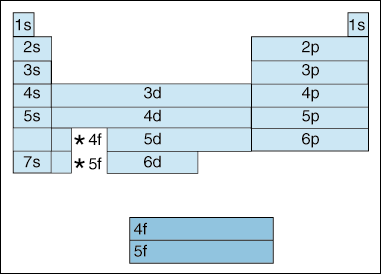
Diese Tabelle veranschaulicht eine Reihe interessanter und komplizierter Merkmale der Elektronenkonfiguration.,
Erstens findet eine Verschiebung statt, wenn Elektronen energiereicher werden. Bis jetzt haben wir gesagt,dass, wie das Prinzip Quantenzahl, erhöht, so auch das Energieniveau des Orbital. Und wie wir oben im Aufbau-Prinzip erwähnt haben, füllen Elektronen niedrigere Energiebahnen, bevor sie höhere Energiebahnen füllen. Das obige Diagramm zeigt jedoch deutlich, dass das 4s-Orbital vor dem 3D-Orbital gefüllt ist., Mit anderen Worten, sobald wir die Quantennummer 3 erreicht haben, verdunkeln die höchsten Unterschalen der niedrigeren Quantenzahlen in Energie die niedrigsten Unterschalen höherer Quantenzahlen: 3d ist von höherer Energie als 4s.
Zweitens zeigt das Obige eine Methode zur Beschreibung eines Elements entsprechend seiner Elektronenkonfiguration an. Wenn Sie sich von links nach rechts über das Periodensystem bewegen, zeigt das obige Diagramm die Reihenfolge, in der Orbitale gefüllt sind. Wenn wir das obige Diagramm tatsächlich in Gruppen aufteilen würden und nicht in die Blöcke, die wir haben, würde es zeigen, wie genau wie viele Elektronen jedes Element hat., Zum Beispiel wird das Element Wasserstoff, das sich in der obersten linken Ecke des Periodensystems befindet, als 1s1 beschrieben, wobei das s beschreibt, welches Orbital Elektronen enthält, und das 1 beschreibt, wie viele Elektronen sich in diesem Orbital befinden. Lithium, das sich im Periodensystem direkt unter Wasserstoff befindet, würde als 1s22s1 beschrieben. Die Elektronenkonfigurationen der ersten zehn Elemente sind unten dargestellt (beachten Sie, dass die Valenzelektronen das Elektron in der Hülle mit der höchsten Energie sind, nicht nur die Elektronen in der Unterschale mit der höchsten Energie).,

Die Oktettregel
Unsere Diskussion über Valenzelektronenkonfigurationen führt uns zu einem der Hauptprinzipien der chemischen Bindung, der Oktettregel. Die Oktettregel besagt, dass Atome werdenspeziell stabil, wenn ihre Valenzschalen ein vollständiges Komplement von Valenzelektronen erhalten. Zum Beispiel haben Helium (He) und Neon (Ne) in oben äußere Valenzschalen, die vollständig gefüllt sind, so dass keiner eine Tendenz hat, Elektronen zu gewinnen oder zu verlieren., Daher existieren Helium und Neon, zwei der sogenannten Edelgase, in freier atomarer Form und bilden normalerweise keine chemischen Bindungen mit anderen Atomen.
Die meisten Elemente haben jedoch keine volle äußere Hülle und sind zu instabil, um als freie Atome zu existieren. Stattdessen versuchen sie, ihre äußeren Elektronenschalen zu füllen, indem sie chemische Bindungen mit anderen Atomen bilden und dadurch eine Edelgaskonfiguration erreichen. Ein Element wird dazu neigen, den kürzesten Weg zum Erreichen der Edelgaskonfiguration zu gehen, unabhängig davon, ob dies bedeutet, ein Elektron zu gewinnen oder zu verlieren., Zum Beispiel kann Natrium (Na), das ein einzelnes Elektron in seinem äußeren 3s-Orbital hat, dieses Elektron verlieren, um die Elektronenkonfiguration von Neon zu erreichen. Chlor, mit sieben Valenzelektronen, kann ein Elektron gewinnen, um die Konfiguration von Argon zu erreichen. Wenn zwei verschiedene Elemente die gleiche Elektronenkonfiguration haben, werden sie isoelektronisch genannt.
Diamagnetismus und Paramagnetismus
Die Elektronenkonfiguration eines Atoms hat auch Auswirkungen auf sein Verhalten in Bezug auf Magnetfelder. Ein solches Verhalten hängt von der Anzahl der Elektronen ab, die ein Atom hat, die spinpaarweise sind., Denken Sie daran, dass Hunds Regel und das Pauli-Ausschlussprinzip zusammen bestimmen, dass sich die Orbitale eines Atoms alle halb füllen, bevor sie sich vollständig füllen, und dass diese beiden Elektronen entgegengesetzte Spins haben, wenn sie sich vollständig mit zwei Elektronen füllen.
Ein Atom, in dem alle seine Orbitale gefüllt sind, und daher alle seine Elektronen, gepaart mit einem Elektron mit entgegengesetztem Spin, werden von Magnetfeldern sehr wenig beeinflusst. Solche Atome werden diagmetisch genannt. Umgekehrt haben paramagnetische Atome nicht alle ihre Elektronen spin-gepaart und werden von Magnetfeldern beeinflusst., Es gibt Grade des Paramagnetismus, da ein Atom ein ungepaartes Elektron oder vier haben könnte.