4.2. Vasogenes Ödem
Störungen im Gefäßkompartiment gehören zu den häufigsten Ursachen für interstitielle Ödeme (vasogenes Ödem) und resultieren aus kapillarer Hypertonie oder Hypoproteinämie. Der Kapillardruck (Pc) wird durch arteriellen (PA) und venösen (PV) Druck und das Verhältnis von prä – zu postkapillaren Widerständen (RA/RV) bestimmt, wie aus der Gleichung hervorgeht :
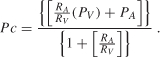
Aus Gleichung (4.1) geht hervor, dass der Kapillardruck ansteigt, wenn der arterielle oder venöse Druck ansteigt und/oder das pre – postkapillare Widerstandsverhältnis abnimmt. Da der arterielle und venöse Druck sowie das pre-to-postcapilläre Widerstandsverhältnis in verschiedenen physiologischen (z., pathologischen Zuständen (z. B. Entzündungen) oder nach Verabreichung vasoaktiver pharmazeutischer Wirkstoffe kann erwartet werden, dass der Kapillardruck und damit die transmikrovaskuläre Filtrationsrate entsprechend diesen Veränderungen schnell ansteigen können. Es wurde jedoch vorgeschlagen, dass der Kapillardruck als Reaktion auf Änderungen des arteriellen oder venösen Drucks durch geeignete Anpassungen des prä – oder postkapillaren Widerstands streng reguliert werden kann, um ein relativ konstantes interstitielles Flüssigkeitsvolumen aufrechtzuerhalten, wenn sich eine dieser Variablen ändert ., Da sich beispielsweise die glatte Gefäßmuskulatur in arteriellen und arteriolären Wänden zusammenzieht, wenn sie erhöhten intravaskulären Drücken ausgesetzt wird, erhöht diese myogene Reaktion den Präkapillarwiderstand und schützt die Kapillaren vor einem gleichzeitigen Anstieg ihres intravaskulären Drucks. Umgekehrt, wenn der arterielle Druck sinkt, wird der myogene Tonus in den Arteriolen reduziert, wodurch ihr Widerstand gegen den Fluss verringert und der Kapillardruck aufrechterhalten wird. Diese Beobachtungen legen nahe, dass der Kapillardruck über denselben Bereich von Druckänderungen reguliert werden kann, über den der Fluss in einem bestimmten Organ autoreguliert wird., In der Tat würde man aus der Beziehung:

vorhersagen, dass die Regulierung des Blutflusses (Q) perfekt an die Regulierung des Kapillardrucks gekoppelt wäre, vorausgesetzt, dass Venendruck und-widerstand konstant bleiben., Eine umfassende Analyse von Änderungen des prä-postkapillaren Widerstandsverhältnisses und Kapillardruckänderungen zeigte jedoch, dass die Wirksamkeit der Durchfluss-und Kapillardruckregulierung nicht immer eng korreliert ist, ein Effekt, der auf passive Dimensionsanpassungen in Kapillaren und Venolen und rheologische Veränderungen im Blut zurückzuführen sein kann, das durch diese Gefäße fließt, wenn sich der arterielle Druck ändert ., Zusätzlich zu dem Puffereffekt von Anpassungen des Pre-to-Postkapillary-Widerstandsverhältnisses auf den Kapillardruck wird der Einfluss von Änderungen des Kapillardrucks, die durch Änderungen des Perfusionsdrucks induziert werden, durch richtungs entgegengesetzte Änderungen des Kapillarfiltrationskoeffizienten minimiert, die auf die Rekrutierung oder Derekruitment von Perfusionskapillaren zurückzuführen sind .
In ähnlicher Weise werden Änderungen des Kapillardrucks und damit der Kapillarfiltration gepuffert, wenn der Venendruck erhöht wird . Mindestens zwei Mechanismen erklären diese Regelung des Kapillardrucks (Abbildung 4.1)., Die myogene Kontraktion der glatten Gefäßmuskulatur in den Wänden der Arteriolen wird durch Übertragung des venösen Druckanstiegs auf diese stromaufwärts liegenden Gefäße ausgelöst . Ein venös-arteriolärer Reflex wurde ebenfalls an dieser Reaktion beteiligt, wobei Erhöhungen des Venendrucks antidrome Impulse aktivieren, die auf Nervenenden übertragen werden, die auf vorgeschaltete Arteriolen auftreffen, wo die Freisetzung von Neurotransmittern eine Verengung auslöst . Neuere Arbeiten haben jedoch die Bedeutung dieses Mechanismus gegenüber der myogenen Reaktion in Frage gestellt ., Es ist wichtig zu beachten, dass der Kapillardruck und damit die Kapillarfiltration als Reaktion auf einen Anstieg des Venendrucks oder-widerstands nicht so gut reguliert ist wie bei einer Veränderung des arteriellen Drucks . Mögliche Auswirkungen eines erhöhten Venendrucks zur Verringerung des Kapillarfiltrationskoeffizienten können jedoch die Reaktion auf einen veränderten Kapillardruck auf die transmikrovaskuläre Flüssigkeitsbewegung puffern, wie oben beschrieben.,
Während sich die vorgenannte Diskussion auf die Wirkung akuter Veränderungen des Venendrucks auf die Regulierung des Kapillardrucks und der transmikrovaskulären Flüssigkeitsbewegung konzentrierte und für die meisten Organe gilt, kann das Dünndarmgefäß in seiner Reaktion auf chronische Veränderungen des Venendrucks einzigartig sein. Chronische intestinale venöse Hypertonie, die durch eine kalibrierte Pfortaderstenose induziert wird, ist mit der Entwicklung eines hyperdynamischen Kreislaufs verbunden, der durch ein erhöhtes Herzzeitvolumen, einen verringerten intestinalen Gefäßwiderstand und einen erhöhten intestinalen Blutfluss gekennzeichnet ist ., Letztere Veränderungen führen zu einem größeren Anstieg des Darmkapillardrucks als bei akuten Venendruckerhöhungen gleicher Größenordnung und sind mit einem Anstieg des Kapillarfiltrationskoeffizienten verbunden . Infolgedessen ist der Anstieg der transkapillären Filtration bei chronischer versus akuter venöser Hypertonie viel größer., Die Mechanismen, die für die Verringerung des intestinalen Gefäßwiderstands verantwortlich sind und die Veränderungen des Kapillardrucks und des Kapillarfiltrationskoeffizienten erklären, die bei chronischer portaler Hypertension zu einer verbesserten Kapillarfiltration führen, beinhalten die Bildung von vasodilatatorischen Substanzen und anderen Faktoren und werden an anderer Stelle überprüft .
Der Kapillardruck ist bei chronischer arterieller Hypertonie nur geringfügig erhöht (~2 mmHg), da der Anstieg des arteriellen Widerstands, der den Anstieg des arteriellen Blutdrucks verursacht, die Übertragung des Druckanstiegs auf das Kapillarniveau puffert ., Dennoch macht der damit verbundene Anstieg der transmikrovaskulären Filtrationsrate weitgehend die erhöhte transkapilläre Fluchtrate von Proteinen aus, die bei dieser Störung durch konvektive Kopplung von Flüssigkeit und Proteinfluss festgestellt wurde. Erhöhter Kapillardruck und Filtrationsrate treten früh im Verlauf der Entwicklung von Diabetes mellitus auf und gelten als wichtiger Stimulus für die kapillare Basalmembranverdickung, das ultrastrukturelle Kennzeichen der diabetischen Mikroangiopathie ., Es wurde berichtet, dass mikrovaskuläre Fäulnis oder Verlust von Kapillaren die Entwicklung von arterieller Hypertonie, Diabetes mellitus und metabolischem Syndrom begleiten . Die damit einhergehende Verringerung der für den Austausch verfügbaren Oberfläche kann den Effekt der kapillaren Hypertonie zur Erhöhung des interstitiellen Flüssigkeitsvolumens unter diesen Bedingungen teilweise ausgleichen.
Ein sehr starker Anstieg des Venendrucks kann zu Erhöhungen der Kapillarfiltration führen, die weit über dem liegen, was aus dem damit verbundenen Anstieg des Kapillardrucks vorhergesagt würde., Dies ist auf druckinduzierte Erhöhungen der mikrovaskulären Permeabilität zurückzuführen, die sich in der Starling-Gleichung durch Erhöhung der hydraulischen Leitfähigkeit und Verringerung des osmotischen Reflexionskoeffizienten manifestieren., Für die meisten Organe können die Permeabilitätseigenschaften der mikrovaskulären Barriere für den Austausch von flüssigen und lipidunlöslichen gelösten Stoffen durch das Vorhandensein einer großen Anzahl kleiner Poren mit Radien von 70 Angströmen oder weniger und einer kleineren Anzahl großer Poren mit Radien von mehr als 200 Angströmen erklärt werden, wobei einige Modelle einen dritten Satz sehr kleiner Poren enthalten (< 10 Angströmen im Radius), um den Diffusionsfluss von Wasser zu berücksichtigen., (Organe wie die Leber, die diskontinuierliche Kapillaren aufweisen, die durch große Lücken zwischen Endothelzellen und Reflexionskoeffizienten von 0,1 gekennzeichnet sind, passen nicht zu diesen Modellen.) Es wird angenommen, dass ein großer Anstieg des Venendrucks diese Poren in der mikrovaskulären Wand vergrößert, was als Phänomen der gestreckten Poren bezeichnet wird . Einzelne Organe zeigen eine differentielle Empfindlichkeit gegenüber der Wirkung eines erhöhten Venendrucks im Hinblick auf die Induktion des Dehnporen-Phänomens., Beispielsweise tritt in Mikrogefäßen der Füße im ruhigen Stehen keine Erhöhung der Permeabilität auf, obwohl der Kapillardruck in den Füßen aufgrund der großen hydrostatischen Säule in Arterien und Venen um mehr als 50 mmHg im Vergleich zu in Rückenlage gemessenen Werten ansteigt Venen. Lungenkapillaren können jedoch bei Erkrankungen wie linksventrikulärem Versagen ein gestrecktes Porenphänomen aufweisen, ein Effekt, der die Lungenödembildung in diesem Zustand verschlimmert .,
Wie oben erwähnt, stellt die myogene Verengung von Arteriolen als Reaktion auf Erhöhungen des arteriellen oder venösen Drucks einen wichtigen Sicherheitsfaktor gegen die Ödembildung bei hydrostatischen Ödemen dar, indem der Anstieg des Kapillardrucks begrenzt und die Anzahl der perfundierten Kapillaren und damit die verfügbare Oberfläche für die Flüssigkeitsfiltration verringert wird, die andernfalls als Reaktion auf arterielle oder venöse Hypertonie oder erhöhten venösen Widerstand auftreten könnte (Abbildung 4.1)., Es ist jedoch wichtig zu beachten, dass selbst bescheidene Erhöhungen des Kapillardrucks, die klein und inkonsequent erscheinen können, zu erheblichen Anstiegen der Flüssigkeitsfiltrationsraten im gesamten Mikrogefäß führen können. Dies liegt daran, dass der normale Nettofiltrationsdruck mit durchschnittlich 0,15 mmHg für eine prototypische Körperkapillare recht gering ist. Somit führt eine Erhöhung des Kapillardrucks um nur 2 mmHg, wie oben bei arterieller Hypertonie festgestellt, zu einer anfänglichen 14-fachen Erhöhung der Flüssigkeitsbewegung aus dem Blut in das Interstitium., Kapillare Hypertonie führt zur Bildung eines proteinarmen Ultrafiltrats, das beim Eintritt in den interstitiellen Raum das interstitielle Flüssigkeitsvolumen erhöht. Aufgrund der Compliance-Eigenschaften des Interstitiums führen kleine Inkremente des interstitiellen Volumens zu sehr großen Anstiegen des Gewebedrucks, wodurch der transkapilläre hydrostatische Druckgradient effektiv reduziert wird, wodurch die weitere Ansammlung von Flüssigkeit begrenzt wird (Abbildung 4.1). Dieser Effekt wird als Reaktion auf Erhöhungen des venösen Abflussdrucks durch das Phänomen der venösen Wölbung verstärkt., Das heißt, das Volumen in den Venen nimmt sofort bei Erhöhung des Venendrucks zu, was zu einem übereinstimmenden Anstieg des interstitiellen Drucks führt, der durch Ausdehnung von engorgierten Venolen und Venen in die interstitiellen Räume verursacht wird (Abbildung 4.1). Im Wesentlichen verschiebt das venöse Engorgement die interstitielle Compliance-Kurve nach links, so dass eine kleinere Änderung des interstitiellen Volumens einen größeren Anstieg des interstitiellen Drucks bewirkt. Erhöhter interstitieller Flüssigkeitsdruck erhöht den Lymphfluss um drei Mechanismen., Erstens liefert erhöhter Gewebedruck den treibenden Druck für den Fluss in die anfängliche Lymphknoten. Zweitens erzeugt ein erhöhter Druck im interstitiellen Kompartiment eine radiale Spannung an den Verankerungsfilamenten, die die extrazelluläre Matrix mit lymphatischen Endothelzellen verbinden, wodurch der anfängliche Lymphdurchmesser lokal erhöht und Lücken zwischen interdigitativen und überlappenden Übergängen zwischen benachbarten lymphatischen Endothelzellen geöffnet werden (Abbildung 3.1)., Diese Spannkräfte erzeugen einen kleinen, vorübergehenden Saugdruck für die Bewegung von interstitieller Flüssigkeit durch vergrößerte Lücken zwischen benachbarten Endothelzellen, die als zweites Einwegventilsystem fungieren, um einen unidirektionalen Fluss vom Interstitium in die Lymphknoten sicherzustellen. Drittens, wenn Flüssigkeit in die Anfangslymphe gelangt, erhöht sie das Volumen in den Lymphangionen und fördert deren kontraktile Aktivität und Lymphfluss. Das Vorhandensein von Ventilen zwischen benachbarten Lymphangionen gewährleistet einen Einwegfluss.,
Wie oben erwähnt, führt kapillare Hypertonie zur Bewegung von proteinarmer Flüssigkeit in die interstitiellen Räume, wodurch die Konzentration von Gewebeproteinen verringert und der kolloidosmotische Druck des Gewebes verringert wird (Abbildung 4.1). Dies erhöht die Wirksamkeit des transkapillären onkotischen Druckgradienten (nc-nt) gegenüber dem hydrostatischen Gradienten (Pc − Pt), der die Filtration begünstigt., Da gelöster Stoff von einem großen Teil des Gelwassers in der extrazellulären Matrix ausgeschlossen ist, wird die Schnelligkeit der Abnahme der Gewebeproteinkonzentration, die als Reaktion auf ein erhöhtes interstitielles Flüssigkeitsvolumen auftritt, erhöht, wodurch die Wirksamkeit des Proteinwaschens als Ödemsicherheitsfaktor erhöht wird., Es ist wichtig anzumerken, dass die Wirksamkeit der Abnahme des osmotischen Gewebedrucks als Ödemsicherheitsfaktor bei schwerer kapillarer Hypertonie aufgrund des oben diskutierten streckporigen Phänomens, das den konvektiv gekoppelten Proteintransport in die Geweberäume erhöht, verringert wird.