eisenoxid, auch genannt durch seine IUPAC name eisen Trihydrat oder eisen (III) oxid, ist eine anorganische verbindung vertreten durch die chemische formel Fe2O3 oder Fe2H6O3 . Es ist eines der wichtigsten Oxide von Eisen, die anderen beiden sind Eisenoxid (Fe3O4) bzw. Eisenoxid (FeO). Es kommt natürlich als Mineral Hämatit .,
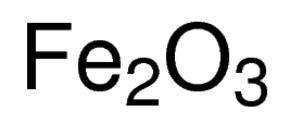
Eisenoxidformel
Hydratisiertes Eisenoxid
Es ist eine rötlich-braune gallertartige Verbindung, die bei Zugabe von Alkali zu Lösungen mit Fe(III) – Salzen hergestellt wird. Es wird auch Hydrous-Eisenoxid genannt und kann chemisch entweder als Fe2O3 dargestellt werden.H2O oder Fe(O)OH . Einige häufige Formen des hydratisierten Eisenoxids sind roter Lepidocrocit, der äußerlich in Rustikeln auftritt, und orangefarbener Goethit, der auf der Innenseite von Rustikeln auftritt.,
Wie wird Eisenoxid hergestellt
Eisenoxid wird im Labor durch Elektrolyse von Natriumbicarbonatlösung, die als inerter Elektrolyt wirkt, und einer Eisenanode synthetisiert. Die elektrolytische Umwandlung von Eisen in hydratisiertes Eisen(III) – Oxid wird dargestellt als:
4Fe + 3O2 + 2H2O → 4 FeO (OH)
Das so produzierte hydratisierte Eisen (III) – Oxid dehydriert bei etwa 200 °C zu Eisenoxid ., Eisensulfat (FeSO4), das weiter zu Eisensulfat oxidiert wird :
- FeS2 + 7O+ H2O → FeSO4 + H2SO4
- FeSO4 + H2SO4 + O → Fe2(SO4)3 + H2O
Aluminium ersetzt Eisen aus Eisenoxid
Aluminium und Eisenoxid durchlaufen eine Redoxreaktion, bei der das Metall Eisen durch Aluminiumoxid ersetzt:
Fe2O3 + 2Al → Al2O3 + 2Fe
Eigenschaften und Eigenschaften von Eisenoxid
Struktur von Eisenoxid
Verwendet
- In der Eisenindustrie zur Herstellung von Stahl und Legierungen .,
- Eisenoxidpulver, auch Juwelierpulver genannt, wird zum Polieren von Linsen und metallischem Schmuck verwendet .
- Seine körnige Form wird als Filtermedium zum Herausziehen von Phosphaten in Salzwasseraquarien verwendet .
- Als FDA-zugelassenes Pigment Brown 6 und Pigment Red 101, zur Verwendung in Kosmetika .
- In biomedizinischen Anwendungen, da seine Nanopartikel ungiftig und biokompatibel sind .
Ist es gefährlich
Eine längere Exposition gegenüber Rauch oder Staub kann zu einer Pneumokoniose mit Fieber, Schüttelfrost, Schmerzen, Atemnot und Husten führen ., Wiederholter Kontakt mit den Augen kann es verfärben und dauerhafte Eisenfärbung verursachen .
- Eisen (III) Oxid – Chemspider.com
- Eisenoxid Rot – Pubchem.ncbi.nlm.hih.gov
- Magnetit (Fe3O4) – Pubchem.ncbi.nlm.nih.gov
- Eisenoxid – Pubchem.ncbi.nlm.nih.gov
- CHEBI:50819-Eisenoxid – Ebi.ac.uk
- Eisenoxidstaub und-rauch (als Fe) – Cdc.gov
- Kinetik und Mechanismus der Dehydratation von γ-FeOOH – Researchgate.net
- Eisen (III) – Oxid-Partikel – Americanelements.com
- Eisenoxid-Chemisches Material.,com
- Magnetische Eigenschaften von Materialien – Sigmaaldrich.com
- Eisen (III) Oxid – Chem.libretexts.org
- Eisenoxid (Fe2O3), Hydrat (Verbindung) – Pubchem.ncbi.nlm.nih.gov
- Die Oxidation von Eisensulfat zu Eisensulfat mittels Luft – Archive.org
- Verwendung von Eisenoxid – Zjunited.com
- Gefahrstoff Fact Sheet Eisenoxid – Nj.gov