jak funguje vyrovnávací paměť?
vyrovnávací paměť je schopna odolat změna pH, protože tyto dvě komponenty (konjugovaná kyselina a konjugovaná báze) jsou oba přítomny v patrném množství v rovnováze a jsou schopny neutralizovat malé množství ostatních kyselin a zásad (ve formě H3O+ a OH -), když jsou přidány do roztoku. Pro objasnění tohoto účinku můžeme zvážit jednoduchý příklad pufru kyseliny fluorovodíkové (HF) a fluoridu sodného (NaF)., Kyselina fluorovodíková je slabou kyselinou v důsledku silné přitažlivosti mezi relativně malé F – ion a solvated protonů (H3O+), který neumožňuje oddělit zcela ve vodě. Proto pokud chceme získat HF ve vodném roztoku, můžeme stanovit následující rovnováze s pouze mírným disociační (Ka(HF) = 6.6×10-4, silně favorizuje reaktanty):
\
pak můžeme přidat a rozpustit fluoridu sodného do roztoku a smíchejte dva, až dosáhneme požadovaného objemu a pH, při které chceme do vyrovnávací paměti., Když Fluorid Sodný se rozpouští ve vodě, reakce půjde na dokončení, tedy získáme:
\
Protože Na+ je konjugovaná silné základny, to nebude mít žádný vliv na pH, nebo reaktivitu vyrovnávací paměti. Přidáním \(NaF\) k řešení bude, nicméně, zvýšení koncentrace F v pufru, a, v důsledku toho, Le chatelierův Princip, vést k mírně nižší disociace HF v předchozím rovnováhy, stejně. Přítomnost významných množství jak konjugované kyseliny, \(HF\), tak konjugované báze, F -, umožňuje řešení fungovat jako pufr., Tento vyrovnávací účinek lze vidět v titrační křivce pufrového roztoku.
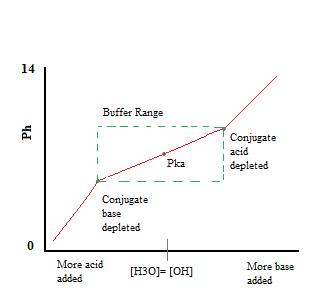
Jak vidíme, přes pracovní rozsah vyrovnávací paměti. pH se mění velmi málo s přidáním kyseliny nebo báze. Po překročení vyrovnávací kapacity rychlost změny pH rychle vyskočí. K tomu dochází, protože konjugovaná kyselina nebo báze byly vyčerpány neutralizací. Tento princip znamená, že větší množství konjugované kyseliny nebo báze bude mít větší pufrovací kapacitu.,
v Případě kyseliny byly přidány:
\
V této reakci, konjugovaná báze, F-, bude neutralizovat přídavkem kyseliny, H3O+, a tato reakce pokračuje až po dokončení, protože reakce F – s H3O+ rovnovážná konstanta větší než jedna. (Ve skutečnosti, rovnovážná konstanta reakce, jak je to napsáno jen inverzní Ka pro HF: 1/Ka(HF) = 1/(6.6×10-4) = 1.5×10+3.,) Tak dlouho, jak tam je víc, F -, než H3O+, téměř všechny H3O+ bude spotřebována a rovnováha se posune doprava, mírně zvyšuje koncentrace HF a mírně klesající koncentrace F-, ale což vede k téměř žádné změně v množství H3O+ dárek jednou rovnováha je obnovena.,
Pokud základny byly přidány:
\
V této reakci, konjugovaná kyselina, HF, bude neutralizovat přidáno množství základnu, OH-, a rovnováha se opět posun vpravo, mírně zvyšuje koncentrace F – v roztoku, a snižuje množství HF mírně. Opět, protože většina OH – je neutralizována, dojde k malé změně pH.
tyto dvě reakce se mohou i nadále střídat tam a zpět s malou změnou pH.