Elektronovou Konfiguraci
elektrony v atomu zaplní jeho atomové orbitaly podle Aufbau Princip, „Aufbau“ v němčině znamená „budování.“Aufbau Princip, který zahrnuje Pauliho vylučovací Princip a Hund je Pravidlo předepisuje několik jednoduchých pravidel pro určení pořadí, ve kterém elektrony vyplnit atomové orbitaly.
- Elektrony vždy vyplnit orbitalu o nižší energii jako první. 1s se vyplní před 2s, a 2s před 2p.,
- princip Pauliho vyloučení uvádí, že žádné dva elektrony v určitém atomu nemohou mít identická kvantová čísla. Ve funkci tento princip znamená, že pokud dva elektrony zabírají stejný orbital, musí mít opačné točení.
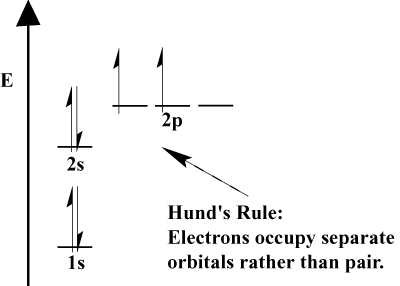
- Hundovo pravidlo uvádí, že když se elektron připojí k atomu a musí si vybrat mezi dvěma nebo více orbitaly stejné energie, elektron raději vstoupí do prázdné orbitaly než do již obsazené., Jak se k atomu přidává více elektronů, tyto elektrony mají tendenci napůl vyplňovat orbitaly stejné energie před spárováním se stávajícími elektrony k vyplnění orbitálů.
Valence a Valenční Elektrony
nejvzdálenější slupce atomu se nazývá valenční vrstva a elektrony ve valenční jsou valenční elektrony. Valenční elektrony jsou nejvyšší energetické elektrony v atomu, a proto jsou nejvíce reaktivní. Zatímco vnitřní elektrony (ty, které nejsou v valence shell) obvykle nemají účastnit chemické vazby a reakce, valenční elektrony mohou být získal, ztratil, nebo sdílené tvořit chemické vazby., Z tohoto důvodu, prvky se stejným počtem valenčních elektronů mají podobné chemické vlastnosti, protože mají tendenci získat, ztratit nebo sdílet valenční elektrony stejným způsobem. Periodická tabulka byla navržena s ohledem na tuto funkci. Každý prvek má v periodické tabulce řadu valenčních elektronů rovnajících se jeho skupinovému číslu.
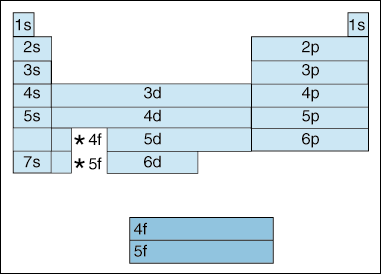
Tato tabulka ilustruje řadu zajímavých a komplikuje, funkce elektronové konfigurace.,
nejprve, jak se elektrony zvyšují v energii, dochází k posunu. Až dosud jsme říkali, že se zvyšuje princip kvantového čísla, stejně jako energetická hladina orbitalu. A jak jsme uvedli výše v principu Aufbau, elektrony vyplňují nižší energetické orbitaly před naplněním vyšších energetických orbitálů. Výše uvedený diagram však jasně ukazuje, že orbital 4s je vyplněn před 3D orbitalem., Jinými slovy, jakmile se dostaneme na principu kvantové číslo 3, nejvyšší slupek na nižší kvantová čísla zatmění v energetické nejnižší slupek vyšších kvantových čísel: 3d je vyšší energie, než 4s.
za Druhé, výše uvedená označuje způsob popisu prvku podle jeho elektronová konfigurace. Jak se pohybujete zleva doprava přes periodickou tabulku, výše uvedený diagram ukazuje pořadí, ve kterém jsou orbitaly vyplněny. Kdybychom byli skutečně rozebrat výše uvedený diagram do skupin, spíše než bloky, které máme, to by ukázat, jak přesně, kolik elektronů každý prvek má., Například, prvek vodík, který se nachází v horním levém rohu periodické tabulky, je popisován jako 1s1, s popisem, které orbital obsahuje elektrony a 1 popisuje, kolik elektronů mají bydliště v tomto orbitalu. Lithium, které se nachází v periodické tabulce těsně pod vodíkem, by bylo popsáno jako 1s22s1. Elektronové konfigurace z prvních deseti prvků jsou uvedeny níže (všimněte si, že valenční elektrony jsou elektron v nejvyšší energetické slupce, ne jen elektrony v nejvyšší energetické podslupky).,

Octet Pravidlo
Naše diskuse o valenční elektronové konfigurace nás vede k jednomu ze základních principů chemických vazeb, oktet pravidlo. Pravidlo oktetu uvádí, že atomy se stávajíobzvláště stabilní, když jejich valenční skořápky získají plný doplněk valenčních elektronů. Například nahoře mají Helium (He) a Neon (Ne) vnější valenční skořápky, které jsou zcela naplněny, takže ani nemá tendenci získávat nebo ztrácet elektrony., Proto Helium a Neon, dva z takzvaných vzácných plynů, existují ve volné atomové formě a obvykle netvoří chemické vazby s jinými atomy.
většina prvků však nemá plný vnější plášť a je příliš nestabilní na to, aby existovala jako volné atomy. Místo toho se snaží naplnit své vnější elektronové skořápky vytvořením chemických vazeb s jinými atomy a tím dosáhnout konfigurace ušlechtilého plynu. Prvek bude mít tendenci jít nejkratší cestou k dosažení konfigurace ušlechtilého plynu, ať už to znamená získání nebo ztrátu jednoho elektronu., Například sodík (Na), který má jeden elektron ve svém vnějším 3S orbitalu, může tento elektron ztratit, aby dosáhl elektronové konfigurace neonu. Chlor se sedmi valenčními elektrony může získat jeden elektron k dosažení konfigurace argonu. Když dva různé prvky mají stejnou elektronovou konfiguraci, nazývají se isoelektronické.
Diamagnetismus a paramagnetismus
elektronová konfigurace atomu má také důsledky na jeho chování ve vztahu k magnetickým polím. Takové chování je závislé na počtu elektronů, které má atom, které jsou spin spárovány., Pamatujte si, že Hund je Pravidlo a Pauliho vylučovací Princip kombinovat diktovat, že atom je orbitaly budou všichni napůl vyplnit před zahájením zcela naplnit, a že když se zcela naplní dva elektrony, tyto dva elektrony, bude mít opačné spiny.
atom se všemi jeho orbitaly naplněnými,a proto všechny jeho elektrony spárované s elektronem opačného spinu, budou magnetickými poli velmi málo ovlivněny. Takové atomy se nazývají diagmetické. Naopak, paramagnetické atomy nemají všechny své elektrony spin-spárované a jsou ovlivněny magnetickými poli., Existují stupně paramagnetismu, protože atom může mít jeden nepárový elektron, nebo může mít čtyři.