oxidu Železitého, také volal podle jeho názvu IUPAC žehlička Trihydrát nebo iron(III) oxide, je anorganická sloučenina zastoupen chemický vzorec Fe2O3 nebo Fe2H6O3 . Jedná se o jeden z nejdůležitějších oxidů železa, další dva jsou oxid železitý (Fe3O4) a oxid železnatý (FeO). Přirozeně se vyskytuje jako minerální hematit .,
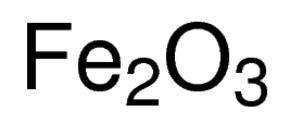
Oxid Železitý Vzorec,
Hydratovaného Oxidu Železitého
je červeno-hnědé želatinové směsi vyrobené na přídavkem alkalických kovů na roztoky obsahující Fe(III) solí. Nazývá se také hydrous oxid železitý a může být chemicky reprezentován buď jako Fe2O3.H2O nebo Fe (o) OH . Některé běžné formy hydratovaného oxidu železitého zahrnují červený lepidocrocit, který se vyskytuje externě v rusticles a oranžový goethit, který se vyskytuje na vnitřní straně rusticles.,
Jak je Oxid Železitý připravený
Oxid dusnatý je syntetizován v laboratoři prostřednictvím elektrolýzy roztoku hydrogenuhličitanu sodného, který působí jako inertní elektrolyt, a železné anody. Elektrolytické přeměny železa do hydratovaná iron (III) oxide je reprezentován jako:
4Fe + 3O2 + 2H2O → 4 FeO(OH)
hydratované iron (III) oxide, takto vyrobené, podléhá dehydrataci kolem 200 °C se tvoří oxid železitý ., na síran železnatý (FeSO4), který se dále oxiduje na železitý sulfát :
- FeS2 + 7O+ H2O → FeSO4 + H2SO4
- 2FeSO4 + H2SO4 + O → Fe2(SO4)3 + H2O
Hliníkové nahrazuje Železa z Oxidu Železitého
Hliníku a oxidu železitého podstoupit redoxní reakce, o který kov se nahrazuje železo tvoří oxid hlinitý:
Fe2O3 + 2Al → Al2O3 + 2Fe
Vlastnosti a Vlastnosti Oxidu Železitého
Konstrukce z Oxidu Železitého
Použití
- V průmyslu železa pro výrobu oceli a slitiny .,
- prášek oxidu železitého, nazývaný také jeweler ‚ s rouge, se používá pro leštění čoček a kovových šperků .
- jeho granulovaná forma se používá jako filtrační médium pro vytahování fosfátů v akváriích se slanou vodou .
- jako FDA schválený Pigment Brown 6 a Pigment Red 101, pro použití v kosmetice .
- v biomedicínských aplikacích, protože jeho nanočástice jsou netoxické a biokompatibilní .
Je to Nebezpečné
Dlouhodobé vystavení jeho výparů nebo prachu může způsobit pneumokoniosy s horečkou, zimnicí, bolesti, dušnost a kašel ., Opakovaný kontakt s očima může odbarvit a způsobit trvalé barvení železa .
- Iron(III) oxide – Chemspider.com
- Oxid Železitý Červená – Pubchem.ncbi.nlm.hih.gov
- Magnetit (Fe3O4) – Pubchem.ncbi.nlm.nih.gov
- oxidu Železnatého – Pubchem.ncbi.nlm.nih.gov
- CHEBI:50819 – železitého – Ebi.ac.uk
- Oxid železitý Prach a Výpary (jako Fe) – Cdc.gov
- Kinetika a mechanismus dehydratace γ-FeOOH – Researchgate.net
- Iron(III) Oxide Částice – Americanelements.com
- Oxidu Železitého – Chemicalbook.,com
- Magnetické Vlastnosti Materiálů – Sigmaaldrich.com
- Iron(III) Oxide – Chem.libretexts.org
- Oxid železitý (Fe2O3), Hydrataci (Látka) – Pubchem.ncbi.nlm.nih.gov
- oxidaci železnatého na železitý sulfát prostřednictvím vzduchu – Archive.org
- Použití Oxidu Železa – Zjunited.com
- Nebezpečné Látky informační List Oxid železitý – Nj.gov