chemický prvek hliník je klasifikována jako ostatní metal. To bylo objeveno v 1750s Andreas Marggraf.,

Data Zone
| Classification: | Aluminum is an ‘other metal’ |
| Color: | silvery |
| Atomic weight: | 26.98154 g/mol |
| State: | solid |
| Melting point: | 660.32 oC, 933.57 K |
| Boiling point: | 2466.85 oC, 2740.,00 K |
| Electrons: | 13 |
| Protons: | 13 |
| Neutrons in most abundant isotope: | 14 |
| Electron shells: | 2,8,3 |
| Electron configuration: | 1s2 2s2 2p6 3s2 3p1 |
| Density @ 20oC: | 2.702 g/cm3 |
Show more, including: Heats, Energies, Oxidation,
Reactions, Compounds, Radii, Conductivities
| Atomic volume: | 9.,98 cm3/mol | ||
| Structure: | fcc: face-centered cubic | ||
| Hardness: | 2.8 mohs | ||
| Specific heat capacity | 0.90 J g-1 K-1 | ||
| Heat of fusion | 10.790 kJ mol-1 | ||
| Heat of atomization | 326 kJ mol-1 | ||
| Heat of vaporization | 293.40 kJ mol-1 | ||
| 1st ionization energy | 577.6 kJ mol-1 | ||
| 2nd ionization energy | 1816.6 kJ mol-1 | ||
| 3rd ionization energy | 2744.,7 kJ mol-1 | ||
| Electron affinity | 42.6 kJ mol-1 | ||
| Minimum oxidation number | 0 | ||
| Min. common oxidation no. | 0 | ||
| Maximum oxidation number | 3 | ||
| Max. common oxidation no. | 3 | ||
| Electronegativity (Pauling Scale) | 1.61 | ||
| Polarizability volume | 8.,> | Reaction with 15 M HNO3 | passivated |
| Reaction with 6 M HCl | mild, ⇒ H2, AlCl3 | ||
| Reaction with 6 M NaOH | mild, ⇒ H2, – | ||
| Oxide(s) | Al2O3 | ||
| Hydride(s) | AlH3 | ||
| Chloride(s) | AlCl3 & Al2Cl6 | ||
| Atomic radius | 125 pm | ||
| Ionic radius (1+ ion) | – | ||
| Ionic radius (2+ ion) | – | ||
| Ionic radius (3+ ion) | 53.,5 pm | ||
| Ionic radius (1- ion) | – | ||
| Ionic radius (2- ion) | – | ||
| Ionic radius (3- ion) | – | ||
| Thermal conductivity | 237 W m-1 K-1 | ||
| Electrical conductivity | 37.6676 x 106 S m-1 | ||
| Freezing/Melting point: | 660.32 oC, 933.,57 K |
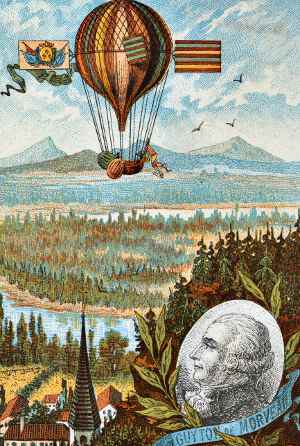
Louis de Morveau věřili, že nové kovové mohla být objevena v oxidu hlinitého. Měl pravdu, ale nedokázal ji izolovat. De Morveau vymyslel první systematickou metodu pojmenování chemikálií a, jak vidíme, byl průkopnickým balonistou.,
Aluminum’s Periodic Table
Neighborhood
| Group 2 or 12 |
Group 13 |
Group 14 |
|
| 2 | 4 Be |
5 B |
6 C |
| 3 | 12 Mg |
13 Al |
14 Si |
| 4 | 30 Zn |
31 Ga |
32 Ge |
Discovery of Aluminum
lidé používají kamenec od starověku pro barvení, opalování a zastavení krvácení. Kamenec je síran draselný.
v roce 1750 německý chemik Andreas Marggraf zjistil, že by mohl použít alkalický roztok k vysrážení nové látky z Kamence. Marggraf byl dříve první osobou, která izolovala zinek v roce 1746.
látka Marggraf získaná z Kamence byla pojmenována alumina francouzským chemikem Louisem de Morveauem v roce 1760. Nyní víme, že oxid hlinitý je oxid hlinitý – chemický vzorec Al2O3.,
De Morveau věřil, že oxid hlinitý obsahuje nový kovový prvek, ale stejně jako Marggraf nebyl schopen extrahovat tento kov z jeho oxidu. (1), (2)
v roce 1807 nebo 1808 anglický chemik Humphry Davy rozložil oxid hlinitý v elektrickém oblouku, aby získal kov. Kov nebyl čistý hliník, ale slitina hliníku a železa.
Davy nazval nový kovový oxid hlinitý, pak jej přejmenoval na hliník. (3)
hliník byl poprvé izolován v roce 1825 Hansem Christianem ørstedem (Oersted) v dánské Kodani, který hlásil: „kus kovu, který v barvě a lesku poněkud připomíná cín.,“
Ørsted vyráběl hliník redukcí chloridu hlinitého pomocí amalgámu draselného a rtuti. Rtuť byla odstraněna zahříváním, aby se opustil hliník.
německý chemik Friedrich Wöhler (Woehler) opakoval Ørstedův experiment, ale zjistil, že poskytuje pouze draselný kov. Wöhler tuto metodu vyvinul o dva roky později a reagoval volatalizovaný trichlorid hliníku s draslíkem na výrobu malého množství hliníku. (1)
v roce 1856 Berzelius uvedl, že to byl Wöhler, kdo uspěl v roce 1827. Wöhler je proto za objev obvykle oceněn.,
nedávno Fogh zopakoval původní experimenty a ukázal, že Ørstedova metoda může poskytnout uspokojivé výsledky.
to posílilo prioritu původního díla ørsteda a jeho postavení objevitele hliníku. (4)
Pro téměř tři desetiletí, hliník zůstal novinka, drahé na výrobu a cennější než zlato, až v roce 1854 Henri Saint-Claire Deville v Paříž, Francie našel způsob, jak nahradit draslíku s mnohem levnější sodíku v reakci izolovat hliník., Hliník se pak stal populárnějším, ale protože byl stále poměrně drahý, byl používán spíše v okrasných než praktických situacích.
a Konečně, v roce 1886 Americký chemik Charles Martin Hall a francouzský chemik Paul Héroult nezávisle vynalezl Hall-Héroult proces, který levně izolátů hliník kov z jeho oxidu elektrolyticky.
hliník se dodnes vyrábí pomocí procesu Hall-Héroult.
Zajímavá Fakta o Hliníku
- Hliníkové výrobní bere hodně energie – 17.,4 megawatt hodin elektrické energie k výrobě jedné tuny hliníku; to je třikrát více energie, než je zapotřebí, aby se tuna oceli. (5)
- Hliník je skvělý kov k recyklaci. Recyklace využívá pouze 5% energie potřebné k výrobě hliníku z jeho rudy, bauxitu. (6)
- hliník se za normálních podmínek nelepí na magnety.
- v zemské kůře je více hliníku než jakýkoli jiný kov. Kolem 8 procent je hliník třetím nejhojnějším prvkem v kůře naší planety, za kyslíkem a křemíkem.,
- navzdory své vysoké hojnosti byl v 50. letech hliník cennější než zlato. V roce 1852 byl hliník oceněn na $1200 za kg a zlato bylo $ 664 za kg.
- ceny Hliníku ilustraci úskalí finanční spekulace: v roce 1854 Saint-Claire Deville našel způsob, jak nahradit draslíku s mnohem levnější sodíku v reakci izolovat hliník. Do roku 1859 byl hliník oceněn na 37 USD za kg; jeho cena klesla o 97% za pouhých pět let.,
- kde předchozí položka zdůrazňuje nebezpečí spekulací, tato položka zdůrazňuje jeden z triumfů chemie: elektrolytický proces Hall-Heroult byl objeven v roce 1886. Do roku 1895 klesla cena hliníku na pouhých 1,20 USD za kg.
- rubínové drahokamy jsou hlavně oxid hlinitý, ve kterém byl malý počet iontů hliníku nahrazen chromovými ionty.
- hliník se vyrábí v jaderných požárech těžkých hvězd, když proton přidává hořčík. (Hořčík se sám vyrábí ve hvězdách jadernou fúzí dvou uhlíků.,) (7)


Vzhled a Vlastnosti
Škodlivými účinky:
Žádné prokázané problémy; požití může způsobit alzheimerovu chorobu
Charakteristika:
Hliník je stříbřitě bílý kov., Nelepí se na magnety (je paramagnetický, a proto je jeho magnetismus za normálních podmínek velmi, velmi slabý). Je to vynikající elektrický vodič. Má nízkou hustotu a vysokou tažnost. Je příliš reaktivní, aby se běžně našel jako kov, i když velmi zřídka lze nalézt nativní kov. (8)
vzhled hliníku je otupělý a jeho reaktivita je pasivována filmem oxidu hlinitého, který se přirozeně vytváří na povrchu kovu za normálních podmínek. Oxidový film má za následek materiál, který odolává korozi., Film může být zahuštěný pomocí elektrolýzy nebo oxidační činidla a hliníku v této podobě bude odolat útoku zředěným kyselinám, zředěným louhům a koncentrované kyseliny dusičné.
Hliníkové leží dostatečně daleko na pravé straně periodické tabulky, která ukazuje některé tipy z nekovový chování, reakcí s louhy horké tvoří hlinito-ionty – stejně jako další typické kovové reakce s kyselinami za uvolňování vodíku a tvoří kladně nabitých kovových iontů, Al3+. Hliník je amfoterní.
čistý hliník je poměrně měkký a nemá sílu., Hliník používaný v komerčních aplikacích má malé množství křemíku a železa (méně než 1%) přidány, což má za následek výrazně lepší pevnost a tvrdost.
použití hliníku
v důsledku nízké hustoty, nízkých nákladů a odolnosti proti korozi je hliník široce používán po celém světě.
používá se v široké škále produktů od nápojových plechovek po okenní rámy a lodě až po letadla. Boeing 747-400 obsahuje 147 000 liber (66 150 kg) vysoce pevného hliníku.
Na rozdíl od některých kovů nemá hliník aroma – proto je široce používán v obalech potravin a hrncích na vaření.,
ačkoli není tak dobrý jako stříbro nebo měď, hliník je vynikající elektrický vodič. Je také výrazně levnější a lehčí než tyto kovy, takže se široce používá v trolejovém vedení.
ze všech kovů se používá pouze železo více než hliník.
Hojnost a Izotopy
Hojnost zemské kůry: 8.23 % hmotnostních, 6.32 % molů
Množství sluneční soustavy: 56 ppm hmotnostních, 2.7 ppm od molů
Náklady, čisté: $15.72 na 100 g
Náklady, objem: $0.,20 na 100 g
Zdroj: Hliník je nejhojnější kov v zemské kůře a je třetí nejčastější prvek v zemské kůře po kyslíku a křemíku. Hliník je příliš reaktivní na to, aby byl nalezen čistý. Bauxit (hlavně oxid hlinitý) je nejdůležitější Ruda.
izotopy: 15 jejichž poločasy jsou známy, hmotnostní čísla 22 až 35. Z nich pouze dva přirozeně vyskytují: 27Al, který je stabilní, a 26Al, který je radioaktivní s poločasem je 7.17 x 105 let. 26Al je tvořen kosmickým paprskovým bombardováním argonu v zemské atmosféře.,

Citovat tuto Stránku
Pro on-line propojení, prosím, zkopírujte a vložte jeden z následujících:
<a href="https://www.chemicool.com/elements/aluminum.html">Aluminum</a>
nebo
<a href="https://www.chemicool.com/elements/aluminum.html">Aluminum Element Facts</a>
citovat tuto stránku v akademickém dokumentu, použijte následující MLA kompatibilní citace:
"Aluminum." Chemicool Periodic Table. Chemicool.com. 26 Jul. 2014. Web. <https://www.chemicool.com/elements/aluminum.html>.