Úvod
Tukové odvozené stromální buňky (ASCs) jsou multipotentních a immunoprivileged, což z nich dělá ideální kandidáty pro léčebné účely (Bourin et al., 2013; Ma et al., 2014; Kallmeyer and Pepper, 2015). Asc lze izolovat pomocí minimálně invazivních technik z různých DEP tukových tkání v těle (Zuk et al., 2001)., Vyznačují se schopností přilnout k plastu, jedinečným profilem povrchových markerů a schopností diferencovat se na kosti, tuk a chrupavku (Dominici et al., 2006; Bourin et al., 2013). Asc zahrnuje ~15-30% stromální vaskulární frakce (SVF) tukové tkáně (Bourin et al., 2013; Zuk, 2013) a je třeba ji rozšířit ex vivo, aby se získal dostatečný počet buněk pro terapeutické účely.,
Poskytování bezpečné a regulované produktů buněčné terapie pro pacienty vyžaduje dodržování správné výrobní praxe (GMP), a pokyny pro správnou výrobní praxi by měly být dodržovány v procesu izolace, rozšiřování a rozlišování ASCs (Giancola et al., 2012). Četné činidla používané k izolaci a rozšířit ASCs pro výzkumné účely jsou živočišného původu, nebo jsou z klinického stupně; proto tyto musí být nahrazeny vhodnější alternativy podle GMP standardů (Halmemu a Kessler, 2006; Riis et al., 2015)., Jsme recenzi volba sérum suplementace, která může být použita pro ASC expanze namísto fetální bovinní sérum (FBS), a popsat jejich účinky in vitro a in vivo, jak je uvedeno v literatuře.,
Mezinárodní Společnosti pro Buněčnou Terapii (ISCT) a Mezinárodní Tuku Použita Technologie Společnosti (IFATS) Zásady a Techniky Používané k Posouzení Tukové Odvozené Stromální Buňky Vlastnosti
stanovit minimální kritéria a pokyny byly doporučeny Mezinárodní Společnosti pro Buněčnou Terapii (ISCT) a Mezinárodní Tuku Použita Technologie Společnosti (IFATS) pro charakterizaci ASCs (Dominici et al., 2006; Bourin et al., 2013)., Tato kritéria zahrnují schopnost asc přilnout k plastu, jejich profil povrchového markeru a jejich potenciál diferenciace trilineage. Nejnovější příspěvek o poloze popisuje životaschopnost a proliferaci jako další měření původních kritérií charakterizace. Dále byly definovány experimentální metody a testy pro měření kritérií charakterizace (Bourin et al., 2013)., Ukázalo se, že tato kritéria jsou ovlivněna mnoha faktory, jako je liposukční technika, technika izolace SVF a média a suplementace používaná během procesu expanze (Koellensperger et al., 2014; Bajek et al., 2015; Busser et al., 2015). Podle ISCT a IFATS pokyny je doporučeno a přijato výzkumné praxe potvrdit dodržování výše uvedených pokynů pro každou izolaci a kultivaci stavu s cílem klasifikovat výsledná populace buněk jako ASCs.,
Techniky a Metody Používané k Charakterizaci ASCs
Morfologie a Dodržování
Jednou nasazený, přívrženec ASCs zobrazení odlišné morfologie, která může být popsán jako tenké, protáhlé a vřetenovité. Morfologické hodnocení asc je obvykle předformováno pomocí světelné mikroskopie (Trojahn Kølle et al., 2013).
Šíření
ISCT a IFATS pokyny doporučují, že šíření a frekvence předek ACSs se měří fibroblastoidní kolonie tvořící jednotky test (Bourin et al., 2013)., Jiné techniky používané ve studiích citovaných v tomto přehledu využívají počítání životaschopných buněk nebo měření proliferační kapacity asc pomocí imunohistochemie. Počítání metody zahrnují (1) počítání buněk pomocí životaschopnost barviva a hemocytometer, (2) počítání buněk pomocí buď počítání korálků nebo techniky barvení a průtokovou cytometrii analýzy, a (3) pomocí kolorimetrické testy, které měří životaschopných buněk na spektrofotometru (Gharibi a Hughes, 2012; Trojahn Kølle et al., 2013; Bogdanova et al., 2014; Atashi et al., 2015; Johal et al., 2015; Oikonomopoulos et al., 2015).,
Imunofenotypu
ISCT a IFATS pokyny uvedené exprese několika povrchových markerů, a jejich očekávaný procentuální hodnoty jako pevný požadavek na jejich místě prohlášení. Rovněž doporučili, aby exprese povrchových markerů byla měřena vícebarevným barvením protilátek (Bourin et al., 2013). Studie v tomto přehledu využily průtokovou cytometrickou analýzu k měření exprese povrchových markerů (Müller et al., 2006; Lindroos et al., 2009; Chieregato et al., 2011; Josh et al., 2012; Trojahn Kølle et al., 2013; Bogdanova et al., 2014; Patrikoski et al., 2014).,
Trilineage Diferenciace
Diferenciace do tukové, kostní a chrupavky se tradičně měří pomocí histochemického barvení techniky vizualizovat pod mikroskopem; nicméně, ISCT a IFATS pokyny doporučují, že kvalitativní hodnocení by měla být nahrazena nebo doplněna kvantitativní přístupy, jako je měření lineage specifické expresi mRNA pomocí reverzní transkripce kvantitativní polymerázové řetězové reakce (RT-qPCR) techniky (Bourin et al., 2013)., Techniky, které byly použity pro měření diferenciace kapacity, popsal ve studiích citovaných v této recenzi, se lišily od histochemické barvení, konvenční PCR a RT-qPCR. Histochemické barvení techniky patří barvení buněk, buď (1) oil red O a nile red pro adipogenesis; (2) Alizarinové červeně S, alkalické fosfatázy a von Kossa pro osteogenesis; nebo (3) Alcian blue a safranin pro chondrogenesis (Müller et al., 2006; Kocaoemer et al., 2007; Hebert et al., 2010; Rajala et al., 2010; Koellensperger et al., 2014; Oikonomopoulos et al., 2015; Riis et al., 2016).,
suplementace séra
fetální bovinní sérum
FBS je tradiční sérový doplněk používaný pro buněčnou kulturu. FBS obsahuje růstové faktory (GFs) a další prvky nezbytné pro ASC upevnění, rozšíření, údržba a proliferaci in vitro (Lennon et al., 1995, 1996; Zuk et al., 2001; van der Valk et al., 2010). FBS je náchylná k dávkové variaci, xenoimunizaci a možné kontaminaci mykoplazmou, viry, endotoxiny a priony (van der Valk et al., 2004, 2010; Chieregato et al., 2011; Kyllonen et al., 2013; Jin et al., 2015)., Zdroj a kvalita FBS může ovlivnit proliferaci a diferenciaci asc a rutinní screening mykoplazmy, endotoxinů a virů se stal důležitým (Naaijkens et al., 2012). Tyto faktory mohou ovlivnit experimentální výsledky a učinit buněčný produkt nebezpečným pro klinické použití (Zuk et al., 2001; van der Valk et al., 2004; Witzeneder et al., 2013).
ASCs jsou immunoprivileged, chybí vyjádření hlavní histokompatibilní komplex II. třídy, stejně jako T a B buněk, kostimulační molekuly (CD80, CD86 a CD40)., In vitro imunogenita a imunosupresivní vlastnosti ASCs jsou obvykle měří co-kultivaci ASCs s periferní krevní mononukleární buňky ve smíšené lymfocytární reakce a měření T-cell proliferative response (McIntosh et al., 2006; Patrikoski et al., 2014). ASCs prokázat, imunomodulační a imunosupresivní vlastnosti, o čemž svědčí jejich schopnost regulovat funkce T-buněk a modulovat sekrece cytokinů in vitro a in vivo (Leto Barone et al., 2013; Roemeling-van Rhijn et al., 2013; Patrikoski et al., 2014)., Tyto vlastnosti vyplývají z nízké imunogenity asc. Většina ASC a dalších mezenchymálních kmenových buněk (MSC) klinická hodnocení (fáze I, II, a III) použití FBS doplněny média, a to bylo hlásil, že imunogenní účinky jsou vyvolané komponenty FBS u lidských subjektů (Sundin et al., 2007; Riis et al., 2015). Například klinická studie s použitím MSCs odvozených od kostní dřeně (BM-MSc) rozšířená v FBS našla protilátky proti složkám FBS (Horwitz et al., 2002)., V klinických studiích, kde byli pacienti léčeni dendritickými buňkami a lymfocyty vystavenými FBS (Selvaggi et al., 1997; Mackensen et al., 2000). V kontrastu, meta-analýza MSC klinických studiích zjištěno, že více než 75% pokusů používá FBS v jejich expanzi buněk protokoly a pouze jedna studie sledovány a prokázány nežádoucí účinky na FBS (Lalu et al., 2012)., Studie in vivo zkoumající imunitní odpověď myší na asc ukázaly zachovanou imunosupresi a imunomodulaci, nízkou imunogenitu a žádnou reakci na FBS (Cho et al., 2009; González et al., 2009). Ačkoli asc jsou rozsáhle testovány v klinických studiích, jejich definitivní použití jako terapeutické činidlo musí být stanoveno. To je dále umocněno použitím předklinických modelů, které nemusí být biologicky relevantní (Monsarrat et al., 2016). FBS může být navíc méně imunogenní u myší a jiných zvířecích modelů než u lidí., Nakonec imunitní odpověď vyvolaná FBS (Selvaggi et al., 1997; Mackensen et al., 2000; Horwitz et al., 2002) by mohl teoreticky ovlivnit odmítnutí transplantovaných buněk v buněčné terapii.
alternativy bez séra
neznámé a nedefinované složení FBS je hlavní nevýhodou. Vhodnější alternativou by být chemicky definované médium se známým složením, jako jsou komerčně dostupné serum-free (SF), nebo XF média (Usta et al., 2014)., Tato média bez séra se mylně domnívají, že neobsahují žádné živočišné produkty, protože termíny SF a XF se často používají zaměnitelně. Média SF jsou však obvykle doplněna zvířecím nebo lidským sérovým albuminem a GFs v nedefinovaných množstvích (Patrikoski et al., 2013). Na druhé straně jsou média bez xenonů chemicky definovaná média obsahující dobře definované složky ve specifických koncentracích (Usta et al., 2014).
růstové faktory
další alternativou k séru je přidání GFs do kultivačního média, buď izolovaně, nebo jako koktejl., Tyto GFs mohou být syntetické, odvozené od zvířat nebo odvozené od člověka. Nahrazení syntetickými GFs je výhodné díky jejich vyšší kvalitě a v důsledku standardizace mezi šaržemi, což nemusí být možné pro GFs odvozené od zvířat nebo lidí. Běžně používané GFs jsou růstový faktor fibroblastu, epidermální růstový faktor a růstový faktor odvozený od destiček (PDGF; Baer a Geiger, 2012; Ahearne et al., 2014). Přidání GFs bylo spojeno se zvýšením proliferace (Hebert et al., 2010; Gharibi a Hughes, 2012)., Zlepšený adipogenní diferenciační potenciál byl dříve hlášen v asc rozšířeném v GF doplněném médiu (Hebert et al., 2010). Další studie však pozorovala negativní vliv na adipogenní a osteogenní diferenciaci u dlouhodobě kultivovaných asc (Gharibi a Hughes, 2012).
sérový Albumin
sérový albumin je bohatý plazmatický protein a může být izolován od lidí a zvířat. Často jsou média SF doplněna sérovým albuminem., Studie porovnávající lidský sérový albumin pro ASC média doplnění našli lepší proliferace, menší vřeteno-jako morfologie a zachována diferenciace do tukové, kostí a chrupavek (Rajala et al., 2010; Johal et al., 2015).
Chemicky Definované XF Střední
Xeno-free médiu byla doporučena jako náhrada za FBS a sérum, protože obsahuje potřebné komponenty pro ASC expanze, nezahrnuje dárce nebo batch-to-batch variability, je GMP vyhovující a má minimální imunogenicitu a příznivé imunosuprese (van der Valk et al., 2004, 2010; Usta et al.,, 2014). Ve srovnání s FBS vedlo použití XF média pro expanzi asc k lepší morfologické kvalitě, zvýšené proliferaci, srovnatelnému imunofenotypu a diferenciaci na tuk, kost a chrupavku (Lindroos et al., 2009; Patrikoski et al., 2013; Oikonomopoulos et al., 2015). Použití médií XF v expanzi ASC vede k tomu, že asc ztrácí schopnost přilnout k plastu (Kyllonen et al., 2013; Patrikoski et al., 2013; Oikonomopoulos et al., 2015). K udržení vlastní charakteristiky plastické adherence spojené s ASC jsou zapotřebí další nátěrové hmoty., Komerčně dostupné médium XF je drahé a příprava interního média XF může být časově náročná a může zvýšit riziko variace šarží a šarží (Lund et al., 2009; Baer et al., 2010; Rajala et al., 2010; Yang et al., 2012; Kyllonen et al., 2013; Patrikoski et al., 2013; Oikonomopoulos et al., 2015).
Lidské Alternativy
Lidské alternativy mohou nahradit FBS a SF/XF doplněny média a může vytvořit kulturu prostředí, které přesněji podobá lidské prostředí (Azouna et al., 2012; Koellensperger et al., 2014)., Kromě toho použití autologních přípravků (odvozených od stejného jedince) eliminuje potřebu testování infekčních a jiných původců onemocnění.
Lidské Sérum
Po celé krve bylo povoleno sraženiny v absenci antikoagulační a byla centrifugována, sérum je výsledná kapalina část, která neobsahuje krevní destičky, bílé krvinky nebo červené krvinky (Obrázek 1; Stedman, 2006). Lidské sérum (HS) může být buď autologní (dárce a příjemce jsou stejní jedinci) nebo alogenní (odvozené od jedinců, kteří se liší od příjemce)., Autologní i alogenní HS jsou lepší než FBS (Stute et al., 2004; Bieback et al., 2009, 2012; Bernardo et al., 2011; Kyllonen et al., 2013; Patrikoski et al., 2013). ASCs rozšířen v HS mají větší transcriptome stability, než ty, rozšířen v FBS, vzhledem k tomu, že geny odpovědné za prodloužení buněčného cyklu, diferenciace a extracelulární matrix a inhibuje syntézu prostaglandinů jsou upregulovány a nadměrně exprimován v FBS, když ve srovnání s HS pomocí microarray analýzy (Shahdadfar et al., 2005)., ASCs rozšířen v FBS dosáhl stárnutí dříve a zobrazí zkrácení telomery oproti ASCs rozšířen v HS (Shahdadfar et al., 2005). Zdá se, že výběr HS má malý vliv na imunomodulační vlastnosti asc. Asc rozšířena buď alogenní HS nebo FBS obsahující média měla nízkou imunogenitu a vyústila v imunosupresi (Patrikoski et al., 2014). Asc rozšířen buď autologní nebo alogenní HS vykazují větší proliferaci a nerozeznatelný imunofenotyp ve srovnání s ASC rozšířen v FBS(Josh et al ., 2012; Bogdanova et al., 2014)., ASCs rozšířen v alogenní HS byly rozlišeny do tukové, kosti a chrupavky, i když upregulace chondrogenic a osteogenních genů byl favorizován oproti FBS (Joshi et al., 2012). Asc rozšířený v autologních HS byl diferencován na tuk a chrupavku; schopnost diferenciace na kost však byla méně zvýhodněná (Bogdanova et al., 2014). Autologní HS může poskytnout asc s lepší proliferací a genomickou stabilitou, jak je stanoveno analýzou mikroarray ve srovnání s alogenní HS (Shahdadfar et al., 2005; Bieback et al., 2009; Bernardo et al., 2011)., Asc rozšířen v alogenní HS vstoupil do zástavy růstu a podstoupil buněčnou smrt (Shahdadfar et al., 2005; Lindroos et al., 2009), který omezuje potenciální výhody alogenní HS. Při autologní HS může být ideální, jeho dostupnost je omezená a mohou být významné rozdíly mezi pacienty ve schopnosti jejich vlastní sérum na podporu růstu jejich vlastních buněk (Lange et al., 2007). Alternativně lze alogenní HS spojit, čímž získáte větší množství pro laboratorní experimentování a můžete podstoupit přísné testování kvality krevní bankou (např.,, testování na nepřítomnost infekčních agens a kontaminaci jinými krevními buňkami) před použitím u lidí (Bieback et al., 2009).
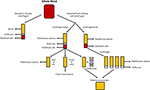
Obrázek 1. Výroba různých lidských alternativ. Sérum se produkuje,když se celá krev může srážet a odstředit na červené a bílé krvinky a krevní destičky. Plazma je produkována prevencí srážení následované centrifugací., V závislosti na rychlosti odstředění se vyrábí buď plazma chudá na destičky (PPP; rychlá odstředění) nebo plazma bohatá na destičky (PRP; pomalejší odstředění). Pokud je PPP skladována při -18 ° C, je známá jako čerstvá zmrazená plazma. Destičkové koncentráty mohou být vyrobeny buď tím, že na platelet poor plasma a 4 buffy kabáty a sdružování je dohromady nebo odstředěním více PRP a sdružování destiček pelety (rozmíchat v malém množství plazmy).,
Plazmové
Plazma je non-celulární kapaliny část krve, která obsahuje vodu, elektrolyty a bílkoviny (koagulační faktory, fibrinogen, a antikoagulancia). Plazma chudá na destičky (PPP), čerstvá zmrazená plazma (FFP) a plazma bohatá na destičky (PRP; Obrázek 1) lze získat z celé krve centrifugací při různých rychlostech a následným skladováním při různých teplotách. Sekrece GF může být zvýšena aktivací krevních destiček v celé krvi trombinem před centrifugací (Doucet et al., 2005; Kocaoemer et al.,, 2007), čímž se zvyšuje aktivita plazmatických produktů.
Platelet Poor Plasma
PPP je téměř bez krevních destiček a je vyroben z plné krve přidáním antikoagulační během kolekce procesu, po kterém se plazma oddělí pomocí rychlého odstředění (Obrázek 1; Koellensperger et al., 2006). To umožňuje peletování krevních destiček a červených krvinek. Výsledná PPP se uchovává při 4 ° C a označuje se jako čerstvá plazma., PDGF je vylučován agregačními destičkami; v PPP se však v důsledku malého počtu zbytkových krevních destiček uvolňuje zanedbatelný PDGF. GFs tedy může být nutné přidat do PPP při použití v médiích, jako je tomu v případě použití sf média(Müller et al ., 2006; Gottipamula et al., 2013). Pomocí PPP bez přidání GFs má za následek nižší proliferace sazby a menší zvýšení syntézy DNA měřené pomocí thymidinu, když ve srovnání s HS a FBS (Vogel et al., 1980; Koellensperger et al., 2006)., PPP s přidanými GFs vedlo ke zvýšení míry proliferace ve srovnání s HS (Koellensperger et al., 2006); tyto rozdíly však mohly vzniknout z různých výrobních protokolů PPP a přidání různých úrovní GFs ke každému z PPP přípravků v této studii. Rozšíření asc v PPP vede ke zlepšení proliferace ve srovnání s FBS a má osteogenní diferenciaci, která je srovnatelná s ASC rozšířenou v HS (Koellensperger et al., 2014)., Chondrogenní diferenciace byla snížena u asc rozšířených v PPP ve srovnání s ASC rozšířeným v PRP (Koellensperger et al., 2014).
čerstvě zmrazená plazma
FFP se získává stejným způsobem jako PPP, ale je zmrazena přímo po oddělení při -18°C (O ‚ Shaughnessy et al., 2004; Liumbruno et al., 2009). FFP byl použit při rozšiřování BM-MSc s pozitivními výsledky., Tyto výsledky patří lepší proliferace, imunosupresivní aktivita a diferenciace do adipocytů a osteocytů, a imunofenotypu a morfologie, která je srovnatelná s buňkami rozšířen v FBS (Müller et al., 2006; Mannello and Tonti, 2007). Použití FFP jako náhražky séra při expanzi ASC však vyžaduje další vyšetřování.
plazma bohatá na destičky
PRP je část krve obohacená o krevní destičky. PRP se vyrábí oddělením plazmy od červených krvinek při pomalejších rychlostech odstředění, což zabraňuje peletování krevních destiček (Obrázek 1)., Asc rozšířený v PRP udržuje klasický imunofenotyp a morfologii a PRP zvyšuje proliferaci ve srovnání s FBS (Kocaoemer et al., 2007; Chieregato et al., 2011; Atashi et al., 2015). Asc rozšířený v PRP mají zlepšenou účinnost diferenciace směrem adipogenních a osteogenních linií, přičemž mají srovnatelnou účinnost pro chondrogenní diferenciaci, ve srovnání s ASC rozšířen v FBS(Kocaoemer et al ., 2007; Chieregato et al., 2011). Při srovnání bylo zjištěno, že HS je o něco lepší než PRP, pokud jde o diferenciaci a proliferaci asc (Kocaoemer et al.,, 2007; Chieregato et al., 2011). PRP je špatně definovaná kultivační médium doplněk vzhledem k jeho vysoké biologické variability a složité extrakční postup, ve kterém čištění destičkového faktoru-bohaté supernatant z plazmatické membrány může být obtížné. Použití PRP je omezeno velkým množstvím celé krve potřebné k získání dostatečného množství PRP pro experimentování (Chieregato et al., 2011).,
Destičkového Lyzátu
Lidského destičkového lyzátu (HPL) obsahuje destiček GFs, které byly získány lysing destiček soustředěna v malém objemu plasmy (koncentráty trombocytů; Obrázek 1) teplotní šok. HPL obsahuje vyšší koncentraci GFs než jiné náhražky séra včetně lidských PRP a FBS (Doucet et al., 2005; Bernardo et al., 2006, 2011; Bieback et al., 2009; Schallmoser et al., 2010)., HPL mohou být snadno získané a vyrobené z aferézy produkty a buffy kabáty, a mohou být resuspendovány v PRP nebo aditivní řešení (Schallmoser a Strunk, 2013; Iudicone et al., 2014). HPL se vyrábí zmrazením krevních destiček při teplotě mezi -30 a -80°C po dobu 24 hodin, následovaným krokem rozmrazování a odstředění. Opakované cykly zmrazení, rozmrazení a odstředivky umožňují uvolňování GFs a odstranění těl destiček (Bernardo et al., 2006; Schallmoser et al., 2007)., Další výhodou suplementace HPL je, že krevní destičky mohou být použity po uplynutí 4-5 dnů v krvi (Bieback et al., 2009). HPL je lepší alternativou, než autologní a alogenní HS, jako ASCs rozšířen v HPL udržovat jejich klasické imunofenotypu, diferenciace, clonogenic účinnosti, mobilní čistoty, a životaschopnosti buněk (Trojahn Kølle et al., 2013; Riis et al., 2016). HPL také podporuje dlouhodobou expanzi bez ohrožení imunomodulačních vlastností asc, měřeno průtokovou cytometrickou analýzou (Bieback et al., 2009)., Rozšíření HPL má za následek kratší dobu zdvojnásobení populace, zkrácení doby potřebné pro expanzi buněk a snížení hrozby stárnutí a transformace (Doucet et al., 2005; Shahdadfar et al., 2005; Bernardo et al., 2006, 2011; Azouna et al., 2012). Bio-bezpečnost HPL byla hodnocena s využitím array komparativní genomové hybridizace a vysoká citlivost spectral karyotyping, kde bylo zjištěno, že ASCs rozšířen v HPL neměl žádné chromozomální aberace (Crespo-diaz et al., 2011; Trojahn Kølle et al., 2013)., Klasická morfologie ASC (tenká, menší, protáhlá a vřetenovitá) je udržována v HS a HPL, zatímco asc rozšířené v FBS jsou větší a méně vřetenovité (Trojahn Kølle et al., 2013). I když to může znamenat, že HS i HPL vybírají pro primitivní / nezralé asc (Doucet et al., 2005; Bieback et al., 2009), také naznačuje, že buňky pěstované v FBS snížily proliferaci a rychleji postupovaly směrem k senescenci. HPL se liší mezi jednotlivci (Bernardo et al., 2006; Crespo-diaz et al., 2011) a variace šarže na šarži se sníží, když se spojí HPL (Schallmoser et al.,, 2007; Trojahn Kølle et al., 2013). Navíc spojením mnoha dárců lze získat velké množství pro doplnění, což činí HPL výhodnější než PRP (Kocaoemer et al., 2007; Bieback et al., 2009; Chieregato et al., 2011).
závěr
podle Riis et al. ze všech registrovaných klinických studií s použitím rozšířené ASCs, které byly uvedeny jejich rozšíření podmínek, většina využít FBS tři pokusy použít autologní HS, jedna studie používá PRP, a jedna studie používá HPL (Riis et al., 2015)., Tyto statistiky jsou alarmující, jako FBS má potenciál k přenosu zoonotických onemocnění po transplantaci buněk, a imunitní reakce proti FBS komponenty byly hlášeny (Selvaggi et al., 1997; Mackensen et al., 2000). FBS je produkt, který není kompatibilní s GMP, protože ovlivňuje bezpečnost a účinnost terapeutického asc, a proto je třeba jej vyměnit (van der Valk et al., 2004; Kyllonen et al., 2013; Witzeneder et al., 2013). To bylo napraveno nahrazením FBS chemicky definovanými alternativami odvozenými od člověka., Změna z FBS na lidské alternativy nebo XF / SF média v regenerační medicíně má důležitou výhodu, že asc proliferují mnohem rychleji, což vede k většímu počtu buněk pro transplantaci v kratším čase. Relativní nadřazenost různých kulturních médií je však stále široce diskutována. Studie porovnávající více než jedno kultivační médium vykázaly různé výsledky (Lange et al ., 2007; Bernardo et al., 2011; Koellensperger et al., 2014; Riis et al., 2016). Koellensperger et al., ve srovnání trilineage diferenciace asc rozšířen v FBS, PRP, PPP, a HS (Koellensperger et al., 2014). Jejich výsledky ukázaly, že každé kultivační médium umožnilo diferenciaci do jedné nebo více linií, ale nikdy do všech tří linií. Když XF media, FBS a HPL doplněné média byly porovnány, Riis et al. zjistil, že některé subpopulace vyjádřily specifické povrchové markery v závislosti na použitém kultivačním médiu (Riis et al., 2016)., Studie porovnání imunofenotypu z ASCs rozšířen v FBS a jiné kultivační média, našel málo, aby žádný rozdíl v povrchu buněk marker projevu, bez ohledu na značky studoval (Tabulka 1). Hustota setí, napětí kyslíku, konflikt, disociace a volba bazálních médií mohou také ovlivnit experimentální výsledky (Sotiropoulou et al., 2006; Freshney, 2010; Bourin et al., 2013; Inamdar a Inamdar, 2013; Feng et al., 2014; Riis et al., 2015)., Výběr kultivačního média závisí na následném použití těchto buněk (podávání diferencovaných nebo nerozlišených asc) a stavu, který je léčen. Kromě toho by měla být imunogenita kultivačního média použitého k rozšíření buněk před klinickou aplikací považována za parametr, který by mohl ovlivnit klinický výsledek. Většina studií porovnávajících různá kulturní média použila kritéria stanovená ISCT a IFATS k ověření použití alternativy k FBS., Většina z těchto studií zkoumat ASC morfologie, množení, imunofenotypu, a schopnost těchto buněk odlišit spolu osteogenní, chondrogenic, a adipogenic linií v různých kultivačních médiích. Několik studií se již zabývalo další aspekty ASCs, jako je stárnutí buněk, genetickou stabilitu, transcriptome, proteomu, imunogenita, sekrece cytokinů a buněčného cyklu (Shahdadfar et al., 2005; Bieback et al., 2012). Zatímco kritéria ISCT a IFATS byla pokusem sjednotit pole z hlediska standardních provozních postupů (Dominici et al., 2006; Bourin et al.,, 2013), neexistuje konsensus, kolem kterého vlastnosti asc jsou relevantní pro klinické studie, takže srovnání různých kulturních médií je prakticky nemožné. Zatímco tato kritéria poskytují měřitelné výsledky pro snadné srovnání, změna složek používaných pro rozšíření asc může mít různé účinky na bezpečnost, účinnost a reprodukovatelnost konečných produktů ASC. Zkoumá změny v transcriptome, proteomu, a secretome z ASCs rozšířen v různých kultivačních médiích je důležité, jako je použití buněk rozšířil za různých podmínek v příslušné preklinické modely.,

Tabulka 1. Účinky různých mediálních doplňků na ASCs in vitro.
Autor Příspěvky
CD koncipován a navrhl recenze, a schválila finální rukopis. MP pomáhal při konceptualizaci přezkumu, revidován, a schválil konečný rukopis. MSP pomáhal při konceptualizaci přezkumu, editoval, a schválil konečný rukopis, a zvýšil financování dotčených projektů. Všichni autoři přečetli a schválili konečný rukopis.,
finanční Prostředky
Tento výzkum a jejich zveřejnění je výsledkem finanční prostředky poskytnuté Rady pro Lékařský Výzkum z Jižní Afriky, pokud jde o (a) MRC je vlajkových lodí Ocenění Projektu SAMRC-RFA-UFSP-01-2013/KMENOVÉ BUŇKY, stejně jako (b) Extramurální Jednotka pro Výzkum Kmenových Buněk a Terapie. Finanční prostředky poskytla také Národní nadace pro výzkum v Jižní Africe.
Prohlášení o střetu zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.,
autoři by chtěli poděkovat Dr. Cheryl Toshové za její redakční pomoc.
Chieregato, k., Castegnaro, s., Madeo, D., Astori, G., Pegoraro, m., and Rodeghiero, F. (2011). Epidermální růstový faktor, základní fibroblastový růstový faktor a počet krevních destiček odvozený růstový faktor-bb může nahradit fetální bovinní sérum a soutěžit s human platelet-rich plasma v ex vivo expanze mezenchymální stromální buňky odvozené z tukové tkáně. Cytoterapie 13, 933-943. doi: 10.3109/14653249.2011.,583232
PubMed Abstract / CrossRef Full Text / Google Scholar
Mannello, F., and Tonti, G. (2007). Stručné hodnocení: žádný průlom pro lidské mezenchymální a embryonálních kmenových buněk kultura: podmíněné střední, podavač vrstvu, nebo feeder-zdarma; střední s fetální telecí sérum, lidské sérum, nebo obohacené plazmy; bez séra, sérum náhradní nonconditioned střední, nebo ad hoc vzorec? všechno, co se třpytí, není zlato! Kmenové Buňky 25, 1603-1609. doi: 10.1634 / stemcells.2007-0127
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Selvaggi, T. a., Walker, R. E.,, a Fleisher, T. A. (1997). Rozvoj protilátek proti fetální telecí sérum s arthus-jako reakce na virus lidského imunodeficitu-u pacientů infikovaných vzhledem syngenních lymfocytární infuze. Krev 89, 776-779.
PubMed Abstract / Google Scholar
Stedman, T. L. (2006). Stedmanův lékařský slovník. Philadelphia, PA: Lippincott Williams & Wilkins.
Google Scholar