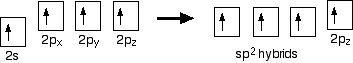jednoduchý pohled na dvojité kovalentní vazby
dvojitá kovalentní vazba je místo, kde jsou mezi atomy sdíleny dva páry elektronů, spíše než jen jeden pár.
některé jednoduché molekuly obsahující dvojné vazby
kyslík, O2
dva atomy kyslíku mohou dosáhnout stabilních struktur sdílením dvou párů elektronů jako v diagramu.
dvojitá vazba je zobrazena konvenčně dvěma čarami spojujícími atomy. Každá čára představuje jeden pár sdílených elektronů.,
Oxid uhličitý, CO2,
Ethene, C2H4
Ethene má dvojnou vazbu mezi dvěma atomy uhlíku.
sofistikovanější pohled na lepení v ethene
je důležité, aby prozkoumala lepení v ethene podrobněji, protože to má přímý dopad na jeho chemii. Pokud nemáte nějaké pochopení skutečné povahy dvojné vazby, nemůžete opravdu pochopit způsob, jakým se ethen chová.,
orbitální výhled na lepení v ethene
Ethene je postaven z atomů vodíku (1s1) a uhlíkových atomů (1s22s22px12py1).
podpora elektronu
atom uhlíku nemá dostatek nepárových elektronů k vytvoření požadovaného počtu vazeb, takže musí podporovat jeden z dvojice 2S2 do prázdného orbitalu 2pz. To je přesně stejný jako stane, když uhlík tvoří vazby – co jiného to skončí připojil.
atom uhlíku je nyní ve vzrušeném stavu.,
Křížení
V případě ethene, tam je rozdíl od metanu, protože každý uhlík je pouze spojení se třemi dalšími atomy, spíše než čtyři. Když atomy uhlíku hybridizují své vnější orbitaly před vytvořením vazeb, tentokrát pouze hybridizují tři orbitaly než všechny čtyři. Používají elektron 2s a dva elektrony 2p, ale ponechávají druhý elektron 2p nezměněný.