Cíle Vzdělávání
- Popsat lytický a lysogenic životní cyklus
- Popsat proces replikace živočišných virů
- Popsat jedinečné vlastnosti retroviry a latentní viry
- o lidské viry a jejich virus-hostitelská buňka
- Vysvětlete proces transdukce
- Popsat proces replikace rostlinných virů
Všechny viry závisí na buňky pro reprodukci a metabolické procesy., Viry samy o sobě nezakódují všechny enzymy nezbytné pro replikaci viru. Ale v hostitelské buňce může virus ovládat buněčné stroje k produkci více virových částic. Bakteriofágy se replikují pouze v cytoplazmě, protože prokaryotické buňky nemají jádro nebo organely. V eukaryotických buňkách se většina DNA virů může replikovat uvnitř jádra, s výjimkou pozorovanou u velkých DNA virů, jako jsou poxviry, které se mohou replikovat v cytoplazmě. RNA viry, které infikují živočišné buňky, se často replikují v cytoplazmě.,
Životní Cyklus Virů s Prokaryote Hostí
životní cyklus bakteriofágů byl dobrý model pro pochopení, jak viry ovlivňují buňky mohou nakazit, protože podobné procesy byly pozorovány u eukaryotických virů, které mohou způsobit okamžitou smrt buňky nebo vytvořit latentní či chronické infekce. Virulentní fágy obvykle vedou ke smrti buňky buněčnou lýzou., Mírných fágů, na druhé straně, může stát součástí hostitelského chromozomu a jsou replikovány s genomu buňky až do doby, kdy jsou nuceny, aby nově sestavený viry, nebo potomstvo virů.
Lytický Cyklus
Během lytický cyklus virulentního fága, bakteriofág trvá přes mobil, reprodukuje nových fágů, a ničí buňky. T-even phage je dobrým příkladem dobře charakterizované třídy virulentních fágů. V bakteriofágovém lytickém cyklu je pět fází (viz Obrázek 1)., Nástavec je první fáze v procesu infekce, ve které fág interaguje se specifickými bakteriální povrchové receptory (např. lipopolysacharidů a OmpC bílkovin na hostitele povrchy). Většina fágů má úzký rozsah hostitele a může infikovat jeden druh bakterií nebo jeden kmen v rámci druhu. Tento jedinečný uznání mohou být využívány pro cílenou léčbu bakteriální infekce fágové terapie nebo pro fágové typizace k identifikaci jednotlivých bakteriálních poddruhů nebo kmeny. Druhým stupněm infekce je vstup nebo penetrace., K tomu dochází kontrakcí ocasního pláště, který působí jako hypodermická jehla pro injekci virového genomu přes buněčnou stěnu a membránu. Hlava fágů a zbývající složky zůstávají mimo bakterie.

Obrázek 1. Virulentní fág zobrazuje pouze lytický cyklus zobrazený zde. V lytickém cyklu fág replikuje a lyzuje hostitelskou buňku.
třetím stupněm infekce je biosyntéza nových virových složek., Po vstupu do hostitelské buňky virus syntetizuje endonukleázy kódované virem, aby degradoval bakteriální chromozom. To pak unese hostitelské buňky k replikaci, přepsat a přeložit potřebné virové komponenty (capsomeres, pláště, základové desky, ocas vláken, a virové enzymy) pro montáž nových virů. Polymerázové geny jsou obvykle exprimovány brzy v cyklu, zatímco kapsidové a ocasní proteiny jsou exprimovány později. Během fáze zrání se vytvářejí nové viriony. Pro uvolnění volných fágů je bakteriální buněčná stěna narušena fágovými proteiny, jako je holin nebo lysozym., Poslední fází je uvolnění. Zralé viry vybuchly z hostitelské buňky v procesu zvaném lýza a potomstvo viry jsou uvolněny do prostředí infikovat nové buňky.
Lysogenic Cyklu
V lysogenic cyklu, genom fága také vstupuje do buňky prostřednictvím upevnění a rozšíření. Hlavním příkladem fága s tímto typem životního cyklu je lambda phage. Během lysogenic cyklu, místo zabíjení hostitele, phage genom se integruje do bakteriálního chromozomu a stane se součástí hostitele. Integrovaný genom fágů se nazývá proroctví., Bakteriální hostitel s prorokem se nazývá lysogen. Proces, při kterém je bakterie infikována mírným fágem, se nazývá lysogenie. Je typické, že mírné fágy jsou v buňce latentní nebo neaktivní. Protože bakterie replikuje svůj chromozom, replikuje také fágovou DNA a předává ji během reprodukce novým dceřiným buňkám. Přítomnost fágu může změnit fenotyp bakterie, protože může přinést další geny (např. toxinové geny, které mohou zvýšit bakteriální virulenci)., Tato změna v hostitelském fenotypu se nazývá lysogenní konverze nebo konverze fágů. Některé bakterie, jako je Vibrio cholerae a Clostridium botulinum, jsou méně virulentní v nepřítomnosti proroka. Fágy infikující tyto bakterie nesou geny toxinu ve svém genomu a zvyšují virulenci hostitele, když jsou exprimovány geny toxinu. V případě v. cholery může fág kódovaný toxin způsobit těžký průjem; u c. botulinum může toxin způsobit paralýzu., Během lysogeny bude proroctví přetrvávat v hostitelském chromozomu až do indukce, což vede k excizi virového genomu z hostitelského chromozomu. Po indukci může mírný fág pokračovat lytickým cyklem a poté podstoupit lysogenu v nově infikované buňce (viz Obrázek 2).

Obrázek 2. Mírný bakteriofág má jak lytické, tak lysogenní cykly. V lysogenním cyklu je fágová DNA začleněna do hostitelského genomu a vytváří proroctví, které se předává dalším generacím buněk., Environmentální stresory, jako je hladovění nebo vystavení toxickým chemikáliím, mohou způsobit vyříznutí proroka a vstup do lytického cyklu.
toto video ilustruje fáze lysogenního životního cyklu bakteriofágu a přechod na lytickou fázi.
Přemýšlejte o tom
- je latentní fág nezjistitelný v bakterii?
Transdukce
Transdukci dochází, když bakteriofág přenáší bakteriální DNA z jedné bakterie do druhé při sekvenčním infekcí., Existují dva typy transdukce: generalizovaná a specializovaná transdukce. Během lytického cyklu virové replikace virus unese hostitelskou buňku, degraduje hostitelský chromozom a vytváří více virových genomů. Jak se sestavuje a balí DNA do fágové hlavy, balení občas udělá chybu. Namísto balení virové DNA trvá náhodný kus hostitelské DNA a vloží ji do kapsidy. Jakmile bude tento virion propuštěn, vstříkne DNA bývalého hostitele do nově infikovaného hostitele., Asexuální přenos genetické informace může umožnit rekombinaci DNA, čímž novému hostiteli poskytne nové geny (např. Gen rezistence na antibiotika nebo gen metabolizující cukr).
generalizovaná transdukce nastává, když je náhodný kus bakteriální chromozomální DNA přenesen fágem během lytického cyklu. Specializovaná transdukce nastává na konci lysogenního cyklu, kdy je proroctví vyříznuto a bakteriofág vstupuje do lytického cyklu. Vzhledem k tomu, že fág je integrován do hostitelského genomu, může se proroctví replikovat jako součást hostitele., Nicméně, některé podmínky (např. ultrafialové světlo expozice nebo chemické expozice) stimulovat prophage podstoupit indukce, což phage spotřební z genomu, zadejte lytický cyklus, a produkovat nové bakteriofágy opustit hostitelské buňky. Během procesu excize z hostitelského chromozomu může fág příležitostně odstranit některé bakteriální DNA v blízkosti místa virové integrace. Phage a hostitelská DNA z jednoho konce nebo obou konců integračního místa jsou zabaleny do kapsidu a jsou přeneseny do nového infikovaného hostitele., Od DNA převedena do fága není náhodně balené, ale je místo toho konkrétní část DNA v blízkosti místa integrace, tento mechanismus přenosu genu se označuje jako specializovaná transdukce (viz Obrázek 3). DNA se pak může rekombinovat s hostitelským chromozomem, což dává druhé nové vlastnosti. Zdá se, že transdukce hraje důležitou roli v evolučním procesu bakterií a dává jim mechanismus pro asexuální výměnu genetické informace.

obrázek 3., Tento vývojový diagram ilustruje mechanismus specializované transdukce. Integrovaný fág vyřízne a přinese s sebou kus DNA sousedící s jeho vkládacím bodem. Při reinfekci nové bakterie se fágová DNA integruje spolu s genetickým materiálem získaným od předchozího hostitele.
- Které fág životní cyklus je spojen s tím, které formy transdukce?,
Životní Cyklus Virů s Zvířecí Hostitelé
Lytické živočišné viry následovat podobné infekce fázích bakteriofágy: přílohu, penetrace, biosyntéza, zrání a uvolnění (viz Obrázek 4). Mechanismy penetrace, biosyntéza nukleových kyselin a uvolňování se však liší mezi bakteriálními a zvířecími viry. Po navázání na hostitelské receptory vstupují zvířecí viry endocytózou (pohlcením hostitelskou buňkou) nebo membránovou fúzí (virová obálka s membránou hostitelských buněk)., Mnoho virů je specifické pro hostitele, což znamená, že infikují pouze určitý typ hostitele; a většina virů infikuje pouze určité typy buněk v tkáních. Tato specificita se nazývá tkáňový tropismus. Příklady jsou demonstrovány na polioviru, který vykazuje tropismu pro tkáních mozku a míchy, nebo virus chřipky, který má primární tropismu pro dýchacích cest.

obrázek 4. Při infekci virem chřipky virové glykoproteiny připojují virus k hostitelské epiteliální buňce. V důsledku toho je virus pohlcen., Virové RNA a virové proteiny jsou vyráběny a sestaveny do nových virionů, které se uvolňují pučením.
zvířecí viry ne vždy vyjadřují své geny pomocí normálního toku genetické informace-od DNA po RNA až po bílkoviny. Některé viry mají genom dsDNA jako buněčné organismy a mohou sledovat normální tok. Jiní však mohou mít ssDNA, dsRNA nebo ssrna genomes. Povaha genomu určuje, jak je genom replikován a exprimován jako virové proteiny., Pokud je genom ssDNA, hostitelské enzymy budou použity k syntéze druhého řetězce, který je komplementární k pramenu genomu, čímž se vytvoří dsDNA. DsDNA může být nyní replikována, přepsána a přeložena podobně jako hostitelská DNA.
Pokud je virovým genomem RNA, musí být použit jiný mechanismus. Existují tři typy genomu RNA: dsRNA, pozitivní ( + ) jednovláknová (+ssRNA) nebo negativní (-) jednovláknová RNA (−ssRNA). Pokud má virus genom + ssRNA, může být přeložen přímo, aby se vytvořily virové proteiny. Virová genomická + ssRNA působí jako buněčná mRNA., Nicméně, pokud se virus obsahuje −ssRNA genomem hostitelské ribozomy nelze přeložit, dokud −ssRNA je replikována do +ssRNA o virové RNA-dependentní RNA polymeráza (RdRP) (viz Obrázek 5). RdRP je přiveden virem a může být použit k výrobě +ssRNA z původního genomu ssRNA. Na RdRP je také důležitý enzym pro replikaci dsRNA viry, protože používá negativní pramen double-stranded genomu jako šablonu vytvořit +ssRNA. Nově syntetizované kopie + ssRNA pak mohou být přeloženy buněčnými ribozomy.,
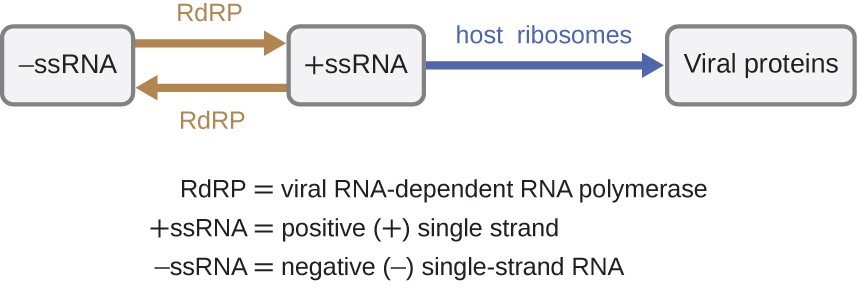
obrázek 5. RNA viry mohou obsahovat + ssRNA, které mohou být přímo čteny ribozomy pro syntézu virových proteinů. Viry obsahující −ssRNA, musí nejprve použít −ssRNA jako šablonu pro syntézu +ssRNA, než virové proteiny mohou být syntetizovány.
u retrovirů je pozorován alternativní mechanismus syntézy virové nukleové kyseliny ,což jsou viry + ssRNA (viz obrázek 6)., Jednovláknové RNA viry, jako je HIV, nesou v kapsidě speciální enzym zvaný reverzní transkriptáza, který syntetizuje komplementární kopii ssDNA (cDNA) pomocí genomu + ssRNA jako šablony. SsDNA je pak vyrobena do dsDNA, která se může integrovat do hostitelského chromozomu a stát se trvalou součástí hostitele. Integrovaný virový genom se nazývá provirus. Virus nyní může zůstat v hostiteli po dlouhou dobu, aby vytvořil chronickou infekci. Provirová fáze je podobná fázi prorokování bakteriální infekce během lysogenního cyklu., Nicméně, na rozdíl od prorokování, provirus nepodléhá excizi po sestřihu do genomu.

obrázek 6. Klikněte pro větší obrázek. HIV, obalený, icosahedrální retrovirus, se váže na buněčný povrchový receptor imunitní buňky a spojí se s buněčnou membránou. Virový obsah se uvolňuje do buňky, kde virové enzymy přeměňují genom jednovláknové RNA na DNA a začleňují jej do hostitelského genomu., (credit: změna práce NIAID, NIH)
- Je RNA-dependentní RNA polymeráza vyrobeny z virového genu nebo hostitelský gen?
Perzistentní Infekce
Perzistentní infekce se vyskytuje, když se virus není zcela vymazán ze systému hostitele, ale zůstane v určitých tkáních nebo orgánech, z infikované osoby. Virus může mlčet nebo podstoupit produktivní infekci, aniž by vážně poškodil nebo zabil hostitele., Mechanismy přetrvávající infekce mohou zahrnovat regulaci virových nebo hostitelských genových výrazů nebo změnu hostitelské imunitní odpovědi. Dvě primární kategorie přetrvávajících infekcí jsou latentní infekce a chronická infekce. Příklady virů, které způsobují latentní infekce zahrnují herpes simplex virus (ústní a genitální herpes), varicella-zoster (plané neštovice a pásový opar), a virus Epstein-Barrové (mononukleóza). Virus hepatitidy C a HIV jsou dva příklady virů, které způsobují dlouhodobé chronické infekce.,
latentní infekce
ne všechny zvířecí viry podléhají replikaci lytickým cyklem. Existují viry, které jsou schopné zůstat skryté nebo spící uvnitř buňky v procesu zvaném latence. Tyto typy virů jsou známé jako latentní viry a mohou způsobit latentní infekce. Viry schopné latence mohou zpočátku způsobit akutní infekci, než se stanou spící.
například virus varicella-zoster infikuje mnoho buněk v celém těle a způsobuje neštovice, charakterizované vyrážkou puchýřů pokrývajících kůži., Asi 10 až 12 dní po infekci, nemoc se vyřeší a virus spí, žije v gangliích nervových buněk po celá léta. Během této doby virus nezabije nervové buňky nebo pokračuje v replikaci. Není jasné, proč se virus přestane replikace uvnitř nervových buněk a vyjadřuje několik virových proteinů, ale v některých případech, obvykle po mnoha letech klidu, se virus znovu aktivuje a způsobuje nové onemocnění zvané pásový opar (Obrázek 7)., Zatímco plané neštovice postihuje mnoho oblastí v celém těle, pásový opar je onemocnění specifické pro nervové buňky vznikající z ganglií, ve kterých byl virus spící.

Obrázek 7. (a) Varicella-zoster, virus, který způsobuje plané neštovice, má zahalila dvacetistěnná kapsidový viditelné v tomto transmisní elektronové mikrofotografie. Jeho dvouvláknový genom DNA se začlení do hostitelské DNA. (b) po období latence se virus může reaktivovat ve formě šindelů, obvykle projevujících se jako bolestivá lokalizovaná vyrážka na jedné straně těla., (kredit: úprava práce Erskine Palmer a. B. G. speciálníinstitucionální rysy—stupnice-bar údajů od Matt Russell, úvěrů, b: změna práce Rosemarie Voegtli)
Latentní viry mohou zůstat spící stávající kruhové virového genomu molekul vně hostitelského chromozomu. Jiní se stávají proviry integrací do hostitelského genomu. Během spánku viry nezpůsobují žádné příznaky onemocnění a mohou být obtížně detekovatelné. Pacient si nemusí být vědom toho, že virus nese, pokud nebyl proveden virový diagnostický test.,
chronická infekce
chronická infekce je onemocnění s příznaky, které se po dlouhou dobu opakují nebo přetrvávají. Některé virové infekce mohou být chronické, pokud tělo není schopno virus odstranit. HIV je příkladem viru, který produkuje chronickou infekci, často po dlouhé době latence. Jakmile se člověk nakazí HIV, virus může být detekován v tkáních nepřetržitě poté, ale neléčení pacienti často nemají žádné příznaky po celá léta., Nicméně, virus udržuje chronické perzistence přes několik mechanismů, které interferují s imunitní funkce, včetně brání expresi virových antigenů na povrchu infikovaných buněk, mění imunitní buňky samotné, omezení exprese virových genů, a rychle se měnící virových antigenů pomocí mutace. Nakonec poškození imunitního systému vede k progresi onemocnění vedoucí k syndromu získané imunodeficience (AIDS)., Různé mechanismy, které HIV používá, aby se zabránilo vylučování imunitním systémem, používají také jiné chronicky infikující viry, včetně viru hepatitidy C.
Přemýšlejte o tom
- jakým dvěma způsoby může virus udržet přetrvávající infekci?
Životní Cyklus Virů s Rostlinných Hostitelů
Rostlinné viry jsou více podobné zvířecí viry, než mají bakteriofágy. Rostlinné viry mohou být obaleny nebo obaleny. Stejně jako mnoho živočišných virů mohou mít rostlinné viry buď genom DNA nebo RNA a být jednovláknové nebo dvojvláknové., Většina rostlinných virů však nemá genom DNA; většina má genom + ssRNA, který funguje jako messenger RNA (mRNA). Pouze menšina rostlinných virů má jiné typy genomů.
rostlinné viry mohou mít úzký nebo široký rozsah hostitele. Například virus citrus tristeza infikuje pouze několik rostlin rodu Citrus, zatímco virus mozaiky okurky infikuje tisíce rostlin různých rostlinných rodin. Většina rostlinných virů je přenášena kontaktem mezi rostlinami nebo houbami, hlísticemi, hmyzem nebo jinými členovci, kteří působí jako mechanické vektory., Některé viry však mohou být přenášeny pouze specifickým typem vektoru hmyzu; například určitý virus může být přenášen mšicemi, ale ne molice. V některých případech mohou viry také vstoupit do zdravých rostlin ranami, ke kterým může dojít v důsledku prořezávání nebo poškození počasí.
Viry, které infikují rostliny jsou považovány za biotrophic parazity, což znamená, že mohou zavést infekci bez zabíjení hostitele, podobné tomu, co je pozorováno v lysogenic životní cyklus bakteriofágů. Virová infekce může být asymptomatická (latentní) nebo může vést k buněčné smrti (lytická infekce)., Životní cyklus začíná pronikáním viru do hostitelské buňky. Dále je virus nepotažen v cytoplazmě buňky, když je odstraněna kapsida. V závislosti na typu nukleové kyseliny, buněčné komponenty se používají k replikaci virového genomu a syntetizují virové proteiny pro sestavení nových virionů. Pro stanovení systémové infekce musí virus vstoupit do části cévního systému rostliny, jako je phloem. Doba potřebná pro systémovou infekci se může lišit od několika dnů do několika týdnů v závislosti na viru, druhu rostlin a podmínkách prostředí., Životní cyklus viru je dokončen, když je přenášen z infikované rostliny na zdravou rostlinu.
Přemýšlejte o tom
- jaká je struktura a genom typického rostlinného viru?
Virové Růst Křivky
na Rozdíl od růstové křivky bakteriální populace, růstová křivka pro virus populace v průběhu jeho životního cyklu není podle esovitě křivky. Během počáteční fáze způsobuje inokulum viru infekci. Ve fázi zatmění se viry váží a pronikají do buněk bez virionů detekovaných v médiu., Hlavní rozdíl, který se dále objeví v křivce virového růstu ve srovnání s bakteriální růstovou křivkou, nastává, když jsou viriony uvolňovány z lysované hostitelské buňky současně. Takový výskyt se nazývá výbuch a počet virionů na uvolněnou bakterii je popsán jako velikost roztržení. V jednom kroku násobení křivka bakteriofága, hostitelské buňky lyse, uvolňuje mnoho virových částic do prostředí, které vede k velmi prudkému nárůstu virové titr (počet virionů na jednotku objemu)., Pokud nezůstanou žádné životaschopné hostitelské buňky, virové částice se začnou zhoršovat během poklesu kultury (viz Obrázek 8).
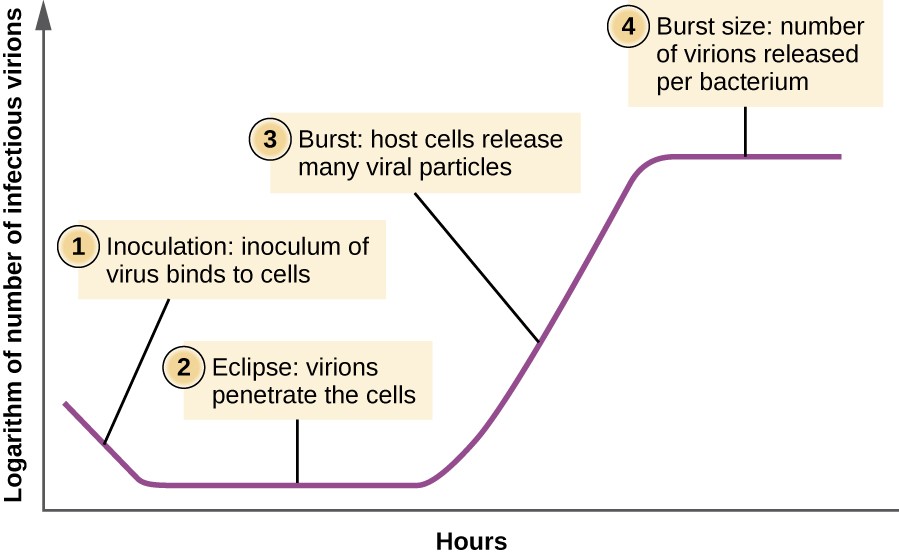
Obrázek 8. One-krok násobení křivka bakteriofága populace následující tři kroky: 1) očkování, při kterém virionů připojit do hostitelských buněk; 2) zatmění, během kterého vstupu virového genomu dochází; a 3) praskla, když dostatečný počet nových virionů jsou vyráběny a vyjít z hostitelské buňky. Velikost roztržení je maximální počet virionů produkovaných na bakterii.,
- Jaký aspekt životního cyklu viru vede k náhlému zvýšení růstové křivky?
Neregistrovaná léčba
Ebola je nevyléčitelná a smrtelná. Ohnisko v západní Africe v roce 2014 bylo bezprecedentní a zakrývalo další lidské epidemie eboly na úrovni úmrtnosti. Z 24 666 nahlášených nebo potvrzených případů zemřelo 10 179 lidí.
nejsou k dispozici žádné schválené léčby nebo vakcíny proti Ebole., Zatímco některé léky prokázaly potenciál v laboratorních studiích a modelech na zvířatech, nebyly u lidí testovány na bezpečnost a účinnost. Nejen, že jsou tyto léky netestované nebo neregistrované, ale jsou také nedostatečné.
vzhledem k velkému utrpení a vysoké úmrtnosti je spravedlivé se ptát, zda neregistrované a netestované léky jsou lepší než vůbec žádné. Měly by být takové léky vydávány, a pokud ano, kdo by je měl přijímat, s ohledem na jejich extrémně omezené zásoby? Je etické léčit netestované léky u pacientů s Ebolou?, Na druhou stranu je etické zadržovat potenciálně život zachraňující léky od umírajících pacientů? Nebo by snad měly být léky vyhrazeny pro poskytovatele zdravotní péče, kteří pracují na potlačení nemoci?
V srpnu 2014, dva infikované NÁS humanitárních pracovníků a španělský kněz byli léčeni ZMapp, neregistrovaný lék, který byl testován na opicích, ale ne u lidí. Dva američtí humanitární pracovníci se zotavili, ale kněz zemřel. Později toho měsíce WHO vydala zprávu o etice léčby pacientů s drogou., Vzhledem k tomu, že Ebola je často fatální, panel odůvodnil, že je etické dávat neregistrované léky a neetické je zadržovat z bezpečnostních důvodů. Tato situace je příkladem „soucitného použití“ mimo zavedený systém regulace a správy terapií.
Ebola v USA
Na září 24, 2014, Thomas Eric Duncan dorazil na Texas Health Presbyterian Nemocnice v Dallasu, si stěžují na horečku, bolest hlavy, zvracení, a průjem—příznaky běžně pozorována u pacientů s nachlazení nebo chřipky., Po vyšetření mu lékař pohotovostního oddělení diagnostikoval sinusitidu, předepsal některá antibiotika a poslal ho domů. O dva dny později se Duncan vrátil do nemocnice sanitkou. Jeho stav se zhoršil a další krevní testy potvrdily, že byl infikován virem Ebola.
Další vyšetřování odhalilo, že Duncan se právě vrátil z Libérie, jedné ze zemí uprostřed závažné epidemie Eboly., 15. Září, devět dní předtím, než se objevil v nemocnici v Dallasu, Duncan pomohl přepravit souseda postiženého Ebolou do nemocnice v Libérii. Nemocnice pokračovala v léčbě Duncana, ale zemřel několik dní poté, co byl přijat.

obrázek 9. Vědci pracující s virem Ebola používají vrstvy obrany proti náhodné infekci, včetně ochranného oděvu, dýchacích systémů a negativních vzduchových tlakových skříní pro práci na lavičce. (kredit: úprava díla Randala J., Schoepp)
časová osa případu Duncan svědčí o životním cyklu viru Ebola. Inkubační doba pro Ebola se pohybuje od 2 dnů do 21 dnů. Mezi Duncanovou expozicí virové infekci a výskytem jeho příznaků uplynulo devět dní. To částečně odpovídá období zatmění v růstu virové populace. Během fáze zatmění by Duncan nebyl schopen přenést nemoc na ostatní. Jakmile však infikovaný jedinec začne vykazovat příznaky, onemocnění se stává velmi nakažlivým., Virus Ebola se přenáší přímým kontaktem s kapičkami tělesných tekutin, jako jsou sliny, krev a zvracení. Duncan mohl tuto nemoc přenést na ostatní kdykoli poté, co začal mít příznaky, pravděpodobně nějaký čas před příjezdem do nemocnice v Dallasu. Jakmile nemocnice si uvědomuje, pacient jako Duncan je napaden virem Ebola, pacient je ihned umístěn do karantény, a úředníky v oblasti veřejného zdraví zahájení vysledovat identifikovat každý, s kým se pacient jako Duncan by mohl ve styku během období, ve kterém byl příznaky.,
Veřejné zdravotní úředníci byli schopni vystopovat 10 vysoce rizikových osob (členů rodiny Duncan) a 50 low-rizikových jedinců je sledovat pro příznaky infekce. Nikdo se nakazil nemocí. Jedna ze sester obviněných z Duncanovy péče se však nakazila. To, spolu s Duncanem je počáteční chybné diagnóze, bylo jasné, že NÁS nemocnicích potřeba zajistit další školení zdravotnického personálu, aby se zabránilo možné epidemie viru Ebola v USA.
- Jaké typy školení mohou připravit zdravotnické pracovníky, aby obsahovaly nově vznikající epidemie, jako je Ebola ohnisko 2014?,
- jaký je rozdíl mezi nakažlivým patogenem a infekčním patogenem?
Klíčové Pojmy a Shrnutí
- Mnoho virů zaměřují na specifické hostitele nebo tkání. Někteří mohou mít více než jednoho hostitele.
- mnoho virů sleduje několik fází infekce hostitelských buněk. Tyto fáze zahrnují připojení, pronikání, odvíjení, biosyntézu, zrání a uvolňování.
- bakteriofágy mají lytický nebo lysogenní cyklus. Lytický cyklus vede ke smrti hostitele, zatímco lysogenní cyklus vede k integraci fágů do hostitelského genomu.,
- bakteriofágy injektují DNA do hostitelské buňky, zatímco zvířecí viry vstupují endocytózou nebo membránovou fúzí.
- zvířecí viry mohou podstoupit latenci, podobně jako lysogeny pro bakteriofág.
- většina rostlinných virů je ssRNA s pozitivním vláknem a může podstoupit latenci, chronickou nebo lytickou infekci, jak je pozorováno u zvířecích virů.
- Na růstové křivky bakteriofága populace je jeden-krok násobení křivky a ne esovitě křivky, ve srovnání s bakteriální růstové křivky.,
- bakteriofágy přenášejí genetickou informaci mezi hostiteli pomocí generalizované nebo specializované transdukce.
Multiple Choice
který z následujících vede ke zničení hostitelských buněk?
- lysogenic cyklu
- lytický cyklus
- prophage
- mírného fága
virus získá obálku, během které z následujících fází?,
- přílohu
- penetrace
- montáž
- verze
která z následujících složek je HIV přivedena do buňky?
- DNA-dependentní DNA polymeráza
- RNA polymeráza
- ribozomu
- reverzní transkriptázy
pozitivní-strand RNA virus:
- musí být nejprve převeden na mRNA dříve, než může být přeložen.
- lze použít přímo k překladu virových proteinů.
- bude degradován hostitelskými enzymy.
- není rozpoznán hostitelskými ribozomy.
Jaký je název pro přenos genetické informace z jedné bakterie do druhé bakterie pomocí fága?,
- vysílač
- penetrace
- vyříznutí
- překlad
- Stručně vysvětlit rozdíl mezi mechanismem vstupu T-i bakteriofága a zvíře virus.
- diskutujte o rozdílu mezi generalizovanou a specializovanou transdukcí.,
- rozlišuje mezi lytickými a lysogenními cykly.
- bakteriofágy mají lytické a lysogenní cykly. Diskutujte o výhodách a nevýhodách pro fág.
- jak reverzní transkriptáza napomáhá retroviru při vzniku chronické infekce?
- diskutujte o některých metodách, kterými jsou rostlinné viry přenášeny z nemocné rostliny na zdravou.
- označte pět fází infekce bakteriofágem na obrázku:
