kyselina-báze (proton transfer) reakce
Pro náš první příklad chemické reaktivity, pojďme se podívat na velmi jednoduché reakce, která se vyskytuje mezi sodný ion a kyseliny chlorovodíkové:
HCl+OH^- \Rightarrow H_20+Cl^-
jedná se o acidobazické reakce: proton je převedena z HCl, kyselina, hydroxid, základna. Produktem je voda (konjugovaná kyselina hydroxidu) a chloridový iont (konjugovaná báze HCl)., Tuto reakci jste nepochybně viděli dříve v obecné chemii. Navzdory své jednoduchosti (a navzdory skutečnosti, že reaktanty a produkty jsou spíše anorganické než organické), tato reakce nám umožňuje poprvé zvážit mnoho základních myšlenek organické chemie, které budeme v tomto textu zkoumat v různých kontextech.
Klíčem k pochopení jen o nějaké reakce mechanismus je pojem elektronové hustoty, a jak je připojen k elektronu pohyb (bond-lámání a dluhopisů-tváření), která se vyskytuje v reakci., Hydroxid ion – konkrétně elektronegativní atom kyslíku v hydroxidu ion – má vysokou elektronovou hustotu z důvodu záporného náboje a polarity vodík-kyslík dluhopisů. Hydroxidový kyslík je bohatý na elektrony.

atom vodíku v HCl má naopak nízkou elektronovou hustotu: je chudý na elektrony. Jak můžete očekávat, něco, co je bohaté na elektrony, je přitahováno k něčemu, co je chudé na elektrony., Jako hydroxid a HCl pohybovat blíže k sobě, osamělý párů elektronů na elektronových bohaté sodný kyslík je přitahován elektron-špatná protonu HCl, a elektronového pohybu dochází k proton. Dva elektrony vodíku a chloru sigma bond jsou odrazeny tím, že to blíží sodný elektronové hustoty, a tedy i dále od protonu a vůči chlóru jádra., V důsledku tohoto elektronu hnutí je to, že vodík chlór dluhopis je rozbité, jako dva elektrony z dluhopisů zcela vymanit z orbitalu 1s na vodíku a stát se osamělý pár v 3p orbitalu na chloridový anion.
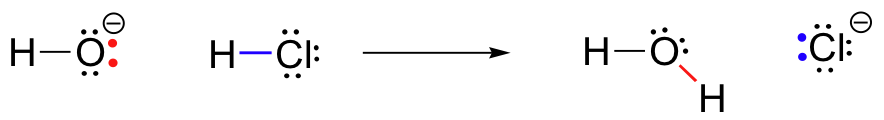
Ve stejné době, že vodík chlór bond je lámání, nová vazba sigma formy mezi vodíku a kyslíku, která obsahuje dva elektrony, které dříve byly osamělé dvojice na hydroxid. Výsledkem této tvorby vazby je samozřejmě molekula vody.
dříve (bod 6.1.,), viděli jsme, jak zakřivené šipky jsou použity pro znázornění elektronového pohybu, který se vyskytuje v chemických reakcích, kde dluhopisy jsou rozbité a nové dluhopisy jsou tvořeny. Reakce HCl + OH je například zobrazena nakreslením dvou zakřivených šipek.
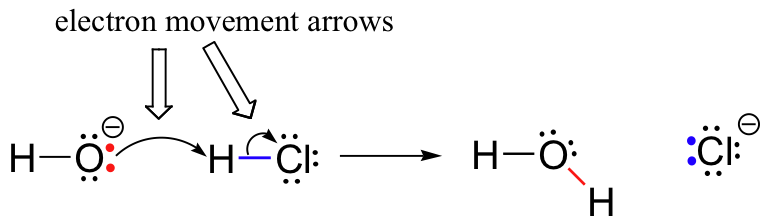
první šipka vzniká na jednom z osamělé páry na hydroxid kyslíku a ukazuje na symbol “ x „v bromovodík molekuly, ilustrující „útok“ kyslíku osamělý pár a následné vytvoření nové vodík-kyslík dluhopisů., Druhý zakřivenou šipku vzniká na vodík brom dluhopisů a body k ‚Br‘ symbol, což naznačuje, že toto pouto je lámání – dva elektrony jsou ‚odchodu‘ a stává osamělý pár na bromidový ion.
v tomto bodě je velmi důležité zdůraznit, že tyto zakřivené, dvoubarevné šipky vždy představují pohyb dvou elektronů. Většina této knihy bude věnována popisu reakčních mechanismů zahrnujících dvouelektronový pohyb, takže tyto plné šípy se stanou velmi známými.,

ve druhém semestru se však podíváme na radikální reakční mechanismy, kde dochází k pohybu jednoho elektronu. Pro tyto procesy bude použita zakřivená, jednobarevná šipka („rybí háček“).
cvičení
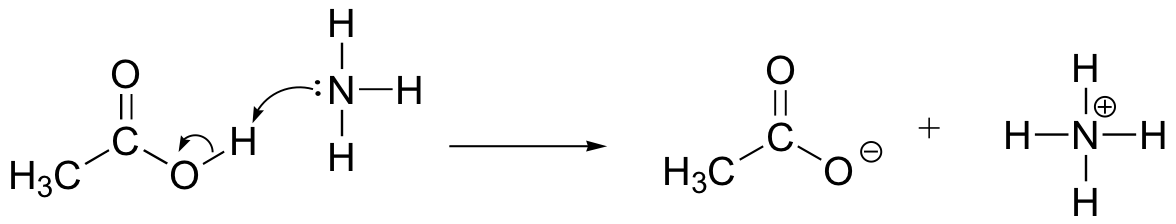
nakreslete šipky pohybu elektronů pro ilustraci acidobazické reakce mezi kyselinou octovou, CH3COOH a amoniakem, NH3. Nakreslete plné Lewisovy struktury reaktantů a produktů.