Ikke alle Kollisioner er Lig
For en gas ved stuetemperatur og normale atmosfæriske tryk, der er omkring 1033 kollisioner i hver kubikcentimeter af plads hvert sekund. Hvis hver kollision mellem to reaktantmolekyler gav produkter, ville alle reaktioner være komplette på en brøkdel af et sekund. For eksempel, når to billardkugler kolliderer, springer de simpelthen af hinanden., Dette er det mest sandsynlige resultat, hvis reaktionen mellem A og B kræver en betydelig forstyrrelse eller omlægning af bindingerne mellem deres atomer. For effektivt at indlede en reaktion skal kollisioner være tilstrækkeligt energiske (eller have tilstrækkelig kinetisk energi) til at medføre denne bindingsafbrydelse. Dette diskuteres yderligere nedenfor.
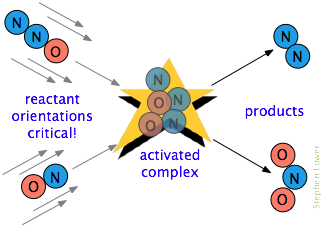
Der er ofte et yderligere krav. I mange reaktioner, især dem, der involverer mere komplekse molekyler, skal de reagerende arter orienteres på en måde, der er passende til den bestemte proces., For eksempel, i gas-fase reaktion af kvælstof oxid med nitrogenoxid, ilt slutningen af N2O skal ramme kvælstof ende af NO; at ændre orienteringen af enten molekyle forhindrer reaktionen. På grund af den omfattende randomisering af molekylære bevægelser i en gas eller væske er der altid nok korrekt orienterede molekyler til, at nogle af molekylerne reagerer. Jo mere kritisk dette orienteringskrav er, desto færre kollisioner vil være effektive.,
Energiske kollisioner mellem molekyler forårsage interatomart obligationer til at strække og bøje, midlertidigt at svække dem, så de bliver mere modtagelige for spaltning. Forvrængning af bindingerne kan udsætte deres tilknyttede elektronskyer for interaktioner med andre reaktanter, der kan føre til dannelse af nye bindinger.,
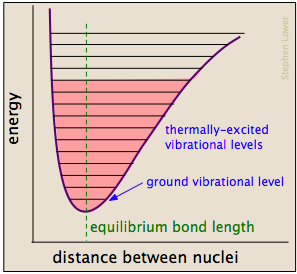
Kemisk obligationer har nogle af de egenskaber, mekaniske fjedre: deres potentielle energi afhænger af, i hvilket omfang de er strækkes eller komprimeres. Hver atom-til-atom-binding kan beskrives ved hjælp af et potentielt energidiagram, der viser, hvordan dens energi ændrer sig med dens længde., Når bindingen absorberer energi (enten fra opvarmning eller gennem en kollision), hæves den til en højere kvantiseret vibrationstilstand (angivet med de vandrette linjer), der svækker bindingen, når dens længde svinger mellem de udvidede grænser svarende til kurven.
en bestemt kollision vil typisk ophidse en række obligationer på denne måde. 10-13 sekunder fordeles denne e .citation blandt de andre bindinger i molekylet på komplekse og uforudsigelige måder, der kan koncentrere den tilsatte energi på et særligt sårbart punkt., Den berørte binding kan strække sig og bøje længere, hvilket gør den mere modtagelig for spaltning. Selv hvis bindingen ikke bryder ved ren strækning, kan den blive forvrænget eller snoet for at udsætte nærliggende elektronskyer for interaktioner med andre reaktanter, der kan tilskynde til en reaktion.