elektronkonfiguration
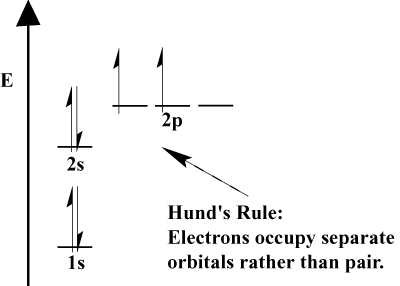
elektronerne i et atom fylder sine atomorbitaler i henhold til Aufbau-princippet; “Aufbau” på tysk betyder “opbygning.”Aufbau-princippet, der inkorporerer Pauli-udelukkelsesprincippet og hunds regel foreskriver et par enkle regler for at bestemme rækkefølgen, hvor elektroner fylder atomorbitaler:
- elektroner fylder altid orbitaler med lavere energi først. 1s er fyldt før 2s, og 2s før 2p.,
- Pauli-udelukkelsesprincippet siger, at ikke to elektroner inden for et bestemt atom kan have identiske kvantetal. I funktion betyder dette princip, at hvis to elektroner optager den samme orbital, skal de have modsat spin.
- hunds regel siger, at når en elektron slutter sig til et atom og skal vælge mellem to eller flere orbitaler af samme energi, vil elektronen foretrække at indtaste en tom orbital snarere end en, der allerede er optaget., Da flere elektroner tilsættes til atomet, har disse elektroner en tendens til at halvfylde orbitaler af den samme energi, før de parres med eksisterende elektroner for at fylde orbitaler.
Rang og Valence Elektroner
Den yderste orbital skallen af et atom kaldes dets valens shell, og elektronerne i valence shell er valence elektroner. Valenselektroner er de højeste energielektroner i et atom og er derfor de mest reaktive. Mens indre elektroner (dem, der ikke er i valensskallen) typisk ikke deltager i kemisk binding og reaktioner, kan valenselektroner opnås, tabes eller deles for at danne kemiske bindinger., Af denne grund har elementer med det samme antal valenselektroner tendens til at have lignende kemiske egenskaber, da de har tendens til at vinde, tabe eller dele valenselektroner på samme måde. Den periodiske tabel er designet med denne funktion i tankerne. Hvert element har et antal valenselektroner svarende til dets gruppenummer på det periodiske bord.
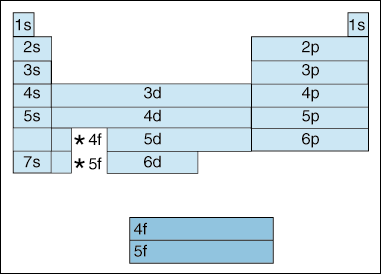
Denne tabel illustrerer en række interessante, og komplicerende, funktioner af elektron konfiguration.,
først, når elektroner bliver højere i energi, finder et skift sted. Indtil nu har vi sagt, at når princippet kvantetal øges, øges også kredsløbets energiniveau. Og som vi har nævnt ovenfor i Aufbau-princippet, fylder elektroner lavere energi orbitaler, før de fylder højere energi orbitaler. Diagrammet ovenfor viser imidlertid tydeligt, at 4S-kredsløbet er fyldt før 3d-kredsløbet., Med andre ord, når vi kommer til princippet quantum nummer 3, den højeste subshells af den lavere quantum numre eclipse i energi de laveste subshells af højere quantum numre: 3d er af højere energi end 4s.
for det Andet, den ovenfor angiver en metode til at beskrive et element i henhold til dens elektron konfiguration. Når du bevæger dig fra venstre til højre på tværs af det periodiske bord, viser ovenstående diagram den rækkefølge, hvor orbitaler er fyldt. Hvis vi var faktisk nedbryde ovenstående diagram i grupper i stedet for de blokke, vi har, ville det vise, hvor præcis hvor mange elektroner hvert element har., For eksempel, elementet af hydrogen, placeret i det øverste venstre hjørne af det periodiske bord, beskrives som 1s1, med S, der beskriver, hvilken orbital der indeholder elektroner, og 1, der beskriver, hvor mange elektroner der bor i den orbital. Lithium, der ligger på det periodiske bord lige under brint, vil blive beskrevet som 1s22s1. Den elektron konfigurationer af de første ti elementer, som er vist nedenfor (bemærk, at valence elektroner elektroner i højeste energi shell, ikke kun elektroner i den højeste energi energikilder).,

Oktet-Reglen
Vores diskussion af valence elektron konfigurationer fører os til en af de kardinale principper i den kemiske binding, oktet-reglen. Oktetreglen siger, at atomer bliverisær stabil, når deres valensskaller får et komplet supplement af valenselektroner. For eksempel har Helium (He) og Neon (Ne) i ovenstående ydre valensskaller, der er fuldstændigt fyldt, så hverken har en tendens til at vinde eller tabe elektroner., Derfor findes Helium og Neon, to af de såkaldte ædelgasser, i fri atomform og danner normalt ikke kemiske bindinger med andre atomer. de fleste elementer har imidlertid ikke en fuld ydre skal og er for ustabile til at eksistere som frie atomer. I stedet søger de at fylde deres ydre elektronskaller ved at danne kemiske bindinger med andre atomer og derved opnå Ædelgaskonfiguration. Et element vil have en tendens til at tage den korteste vej til at opnå Ædelgaskonfiguration, hvad enten det betyder at få eller miste en elektron., For eksempel kan natrium (Na), som har en enkelt elektron i sin ydre 3s orbital, miste den elektron for at nå elektronkonfigurationen af neon. Klor, med syv valenselektroner, kan få en elektron for at nå konfigurationen af argon. Når to forskellige elementer har samme elektronkonfiguration, kaldes de isoelektroniske.
diamagnetisme og paramagnetisme
elektronkonfigurationen af et atom har også konsekvenser for dets opførsel i forhold til magnetfelter. En sådan adfærd er afhængig af antallet af elektroner et atom har, der er spin parret., Husk, at hunds regel og Pauli-udelukkelsesprincippet kombineres for at diktere, at et atoms orbitaler alle vil blive halvt fyldt, før de begynder at fylde helt, og at når de helt fylder med to elektroner, vil disse to elektroner have modsatte spins.
et atom med alle dets orbitaler fyldt, og derfor vil alle dets elektroner parret med en elektron af modsat spin blive meget lidt påvirket af magnetfelter. Sådanne atomer kaldes diagmetiske. Omvendt har paramagnetiske atomer ikke alle deres elektroner spin-parret og påvirkes af magnetfelter., Der er grader af paramagnetisme, da et atom kan have en uparret elektron, eller det kan have fire.