introduktion
forståelsen og styringen af V/relationships-relationer repræsenterer acornerstone of intensive care unit (ICU) patient management. TheV / relationship forhold (Fig. 1) kan betragtes som et spektrum bet .eendeadspace (uendelig V/)) og shunt (nul V/.).
Når pulmonarycapillary blod er udsat for en alveolære partialtryk ofoxygen (PAO2), ilt molekyler flytte ind theplasma som opløst O2 og fortsætter med at øve partialpressure.,
de fleste af disse o .ygenmolekyler kombineres straks medhæmoglobin og indtast en tilstand, hvor de ikke længere direkte overstiger partialtryk. Denne proces fortsætter indtil et delvis trykradient mellem alveolus og plasma eksisterer ikke længere, påhvilket punkt hæmoglobinet er maksimalt mættet for blodetpo2.
Selv om den ilt, der er opløst i plasmarepresents kun 1,5% til 3 % af den samlede ilt i blodet, thePO2 værdi er vigtig fordi den bestemmer drivingforce for ilt og bevægelse ind og ud af blodet.,
Perfect bloodgas udveksling ville kræve hver alveolus at blive ventileretperfekt og alt blod udstødes fra højre ventrikel tiltraverse helt funktionelle lungekapillærer. Derudover skulle diffusion over den alveolære / kapillære membran være udelukket.
fordi alt blod, der passerer fra højre ventrikel til venstre ventrikel, ville nå perfekt ligevægt med alveolargas, ville den alveolære PO2 (PAO2) og arterielle PO2 (PaO2) være identisk.
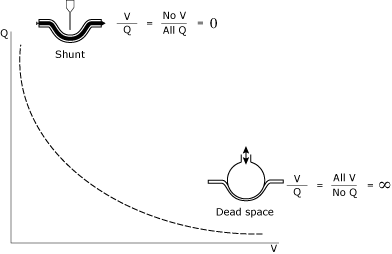
FIG. 1., Den matematiske og konceptuelle illustration af shunt og deadspace.
Som vist i Fig. 2, iltning i de normale lunger kanafviger fra den ideelle situation, fordi fordelingen af perfusioner ujævn.
relativt mere blodgennemstrømning forekommer ityngdekraftafhængige områder, og en vis venøs dræning (frabronchiale, pleurale og Thebesian vener) tømmes direkte ind ivenstre side af hjertet og dermed omgå (shunting) den normaleo .ygeneringsmekanisme .,
På grund af dette kommer noget blod ind ivenstre ventrikel med et lavere iltindhold end blodetudveksling med en ideel alveolus. Figur 3 repræsenterer resultant lavere PaO2 niveau sammenlignet med denberegnede ideelle iltspænding.
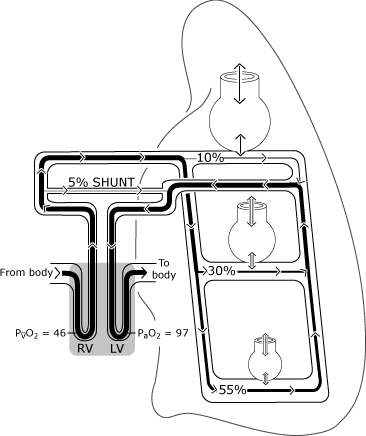
FIG. 2. Den normale lunge har ufuldkommen fordeling af ventilation og perfusion, der primært bestemmes af tyngdekraften. Illustrationen antager en lodret holdning, så lungebaserne er i den tyngdekraftafhængige position., De ikke-tyngdekraftafhængige alveoler er større, men modtager mindre gasudveksling (ventilation) end de tyngdekraftafhængige alveoler. Fordelingen af perfusionen er primært reguleres af tyngdekraften med omkring 55%, der strømmer til tyngdekraften områder, 30 % til mid-lunge-områder, og 10 % at de ikke-tyngdekraften lunge områder. PaO2 og PvO2 udtrykkes i mmHg (kPa = mmHg 0 0,133); RV = højre ventrikel; LV = venstre ventrikel. Gengivet med tilladelse fra Elsevier Health Sciences.
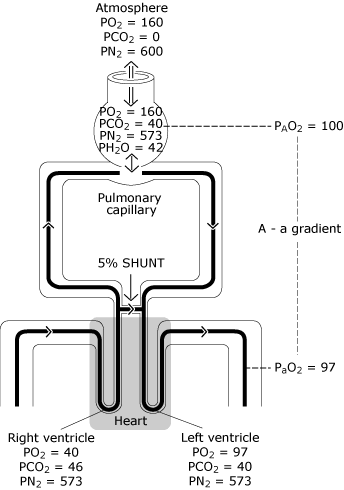
FIG. 3., Den normale lunge har ufuldkommen fordeling af ventilation, ufuldkommen fordeling af perfusion og en vis minimal grad af intrapulmonal shunting. Resultatet er et fald i PO2 fra den beregnede ideelle alveolære værdi (PAO2) til den målte systemiske arterielle blodværdi (PaO2). Denne PO2-forskel er kendt som” den alveolære til arterielle iltspændingsgradient”. PO2 = ilt spænding, der er udtrykt i mmHg; PCO2 = kuldioxid tension udtrykt i mmHg; PN2 = nitrogen spænding, der er udtrykt i mmHg; PH2O = vanddamp spænding, der er udtrykt i mmHg. (kPa = mmHg 0 0,133)., Gengivet med tilladelse fra Elsevier Health Sciences.
Shunt og hypoxemia
Anatomiske rangering er defineret som blod, der går fra højre sideto den venstre side af hjertet, uden at gennemkører pulmonarycapillaries. Kapillær shunting er defineret som blod, der går fraden højre side af hjertet til venstre side af hjertet viapulmonale kapillærer, der støder op til uventilerede alveoler.
begge tilfælde tillader blod at komme ind i venstre sidet cirkulation udenen stigning i iltindholdet., Dette kaldes nul V / Q, ellertrue shunting, fordi blodet ikke har haft mulighed for gasudveksling med funktionelle alveoler.
et eksempel på shunting iklinisk indstilling er de gasudvekslingsabnormiteter, der ses ilungebetændelse ved frigivelse af endotoksin, der fører til cellulært ødemog vasokonstriktion .
Shunting og hypo .æmi er ikke synonyme udtryk, og de har heller ikke lineære relationer. Den hypo .emiske virkning af enhver shunt vilafhænger ikke kun af størrelsen af shunten, men også på O .ygenationsstatus for det venøse blod, der shunts(SVO2)., En lille shunt med en lowSVO2 kan have svære hypoxemic effekter,der henviser til, at en stor shunt med en høj SvO2 willcause mindre væsentlige hypoxemia.
Det kan være udtalte utvetydigt, at når hypoxemia eksisterer, somedegree af shunting (intrapulmonary eller intracardiac) skal bepresent; men effekten af shunt på thePaO2 afhænger i høj grad af cardiovascularfunction og metaboliske sats. Arteriel hypo .æmi er et resultat af lungefunktion, kardiovaskulær funktion og metabolisme.,
vurdering aflunger som O .ygenator er vigtig i plejen af mange patienterkræver kardiopulmonal understøttende pleje. Beregning afintrapulmonal shunting repræsenterer det bedste tilgængelige middel tilafslutte i hvilket omfang lungesystemet bidrager tilhypo .æmi.
intrapulmonal shunt
som tidligere nævnt defineres den intrapulmonale shunt som denportion af hjertets output, der kommer ind i venstre side af hjertet uden at gennemgå perfekt gasudveksling med fuldstændig funktionellealveoler. Intrapulmonal shunt kan opdeles i trekomponenter.,
- Anatomiske rangering er tidligere blevet beskrevet som blod, der kommer ind i venstre side af hjertet, uden at gennemkører pulmonale kapillærer. Ud over normal anatomisk shunting fra bronchiale, pleurale og Thebesiske årer kan anatomisk shunting øges ved vaskulære lungetumorer og højre til venstre intrakardiale shunts.
- kapillær shunting er forårsaget, når blod krydser lungekapillærer, men ikke ækvilibrerer med alveolær gas på grund af patologiske processer som atelektase, lungebetændelse og akut lungeskade.,
- venøs blanding forekommer, når blodet ækvilibrerer med en alveolær PO2, der er mindre end ideel som i situationer med lav V/Q . Fordi venøs blanding ikke er sand shunt, fører dette undertiden til forvirring. Summen af anatomiske og kapillære shunts kaldes oftest nul V / or eller sand shunt. Venøs blanding kaldes ofte lav V / or eller “shunt effekt”. Fysiologisk shunt i normale eller ikke-syge lunger er en måling af normal intrapulmonal shunt. I indstillingen af lungepatologi repræsenterer fysiologisk shunt primært sværhedsgraden af sygdomstilstanden.,
shuntligningen
ligningen, der bruges til at beregne shuntdelen af hjertets output, antager, at den ikke-shunting gas perfekt o .ygeneres ved udveksling med perfekt alveolær gas.
selvom detintrapulmonale shunt-koncept ikke afspejler regionaleforhold, ligesom ventilationsperfusionskonceptet gør detafspejler den grad, i hvilken lungen afviger fra idealet som ano .ygenator af lungeblod.
det er denne kvantitative evne til Atse på lungerne som en O .ygenator, der gør denne måling unik og værdifuld i den kliniske indstilling., Denne anmeldelse bruger term fysiologisk shunt med henvisning til den intrapulmonale shuntberegnet med patienten, der trækker vejret mindre end 100% ilt.
afledningen af shuntligningen kommer fra begreberne ofFick. I 1870, og han indførte det klassiske forhold, at thequantity af ilt til rådighed for væv udnyttelse per enhed timeincludes det arterielle iltindhold (CaO2)ganget med den mængde af blod præsenteres for thetissues per tidsenhed (dvs, cardiac output, Qt).,
Ligning 1:
Ilt til rådighed =(Qt)(CaO2)
Ilt tilbage til lungerne omfatter cardiac output(Qt) ganget med det blandede venøse ilt indhold(CVO2).
Ligning 2:
Ilt tilbage =(Qt)(CvO2)
Oxygen forbrug pr time (VO2) bør reflectthe ilt, der er blevet udvundet fra blod i, at timeperiod.,
Ligning 3:
VO2 = (Qt)(CaO2)– (Qt)(CvO2)
Ligning 3, så kan skrives som: hvad er classicallydescribed som de Fick Ligning.
Ligning 4:
VO2 = Qt(CaO2 –CvO2)
Omarrangeret algebraically, Ligning 4 kan udtrykkes som enfunktion af cardiac output.,
Ligning 5:
Qt = VO2/(CaO2 –CvO2)(10)
for At udtrykke hjertets minutvolumen i liter per minut oxygendifference skal være
ganget med en faktor 10.
To andre ligninger, som man skal blive bekendt er theclassic shunt ligning (Ligning 6), der beskriver ratiobetween kastet cardiac output og alt cardiac output(QS/Qt). Det måles med patientenvejrtrækning 100 % ilt.,
Ligning 6:
QS/Qt = (CcO2 –CaO2)/(CcO2 –CvO2)
De fysiologiske shunt ligning (QSP/Qt) isanother måde at udtrykke Ligning 6, når den måles med patientbreathing mindre end 100 % ilt og nogle venøs iblanding eksisterer.Derfor er de fysiologiske shunt ligning er:
Ligning 7:
QSP/Qt = (CcO2 –CaO2)/ (CcO2 –CvO2)
QSP/Qt har den fordel, at beingderived som et forhold, så ingen absolut måling af hjertets minutvolumen isrequired., I denne form, den ligning, der klart viser, at asthe kastet cardiac output nærmer sig nul, det arterielle oxygencontent skal henvende sig til den teoretiske ende pulmonal capillaryoxygen indhold.
Så længe en del af cardiac output doesnot perfekt udveksling med perfekt alveolerne, arteriel oxygencontent skal være mindre end den ideelle ende pulmonal kapillær oxygencontent.
konsekvenserne af de fysiologiske shunt ligning kan beconceptualized ved betragtning af ilt indhold, form(CcO2, CaO2,CvO2) som enheder, der kan hældes i acontainer (Fig. 4)., Visse faktorer, såsom hæmoglobinkoncentration, kan påvirke alle tre niveauer.
den vigtigste kliniske variabel, der påvirker CcO2, erfio2, hvorimod både total minutvolumen og iltforbrug påvirker CvO2. Ændringer ifysiologiske shunt påvirker CaO2.
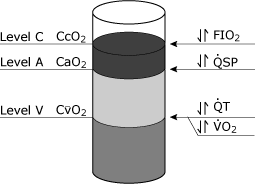
FIG. 4. Skematisk repræsentation af iltniveauer i blodet, der teoretisk kunne opnås fra tre separate steder i det kardiovaskulære system. Niveau C repræsenterer endepulmonal kapillærblodets iltindhold (CcO2)., Niveau A repræsenterer det systemiske arterielle blod iltindhold (CaO2), og niveau V repræsenterer det blandede venøse (lungearterie) blod iltindhold (CvO2). De mest almindelige kliniske variabler, der specifikt berører disse forskellige niveauer er vist: Plan C er mest almindeligt påvirket af ændringer i FIO2 (inspireret ilt fraktion), Niveau A er specielt påvirket af ændringer i de fysiologiske shunt (QSP), Niveau V er specielt påvirket af både den samlede cardiac output (QT) og andelen af iltoptagelse (VO2). Gengivet med tilladelse fra Elsevier Health Sciences.,
tælleren af shunt ligningen er repræsenteret afforskelle i cco2 ogcao2. Nævneren af ligningen errepræsenteret af forskellene i CcO2 ogcvo2.
ændringer af ulige størrelse blandtdisse tre niveauer vil ændre forholdet, hvilket svarer tilændringer i den fysiologiske shuntberegning.
Hvis en patient udvikler sigfulminant højre-, mellem – og nedre lobkonsolidering, ville dearterielle og pulmonale arterieblodgasmålinger afsløre etklinisk billede som afspejlet i Fig. 5.,
den arterielle o .ygentension og indhold er signifikant reduceret på grund af en storintrapulmonal shunt. Hvis hjerteudgangen forbliver uændret Ogden arterielle blandede venøse o .ygenforskel ændres ikke, Såcvo2 skal også falde.
På grund afændring af ulige størrelse vil den fysiologiske shunt i høj grad stige sekundært til hypo .æmi.
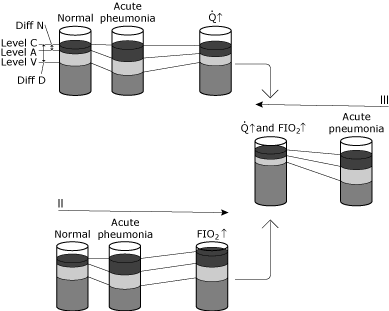
FIG. 5. Skematisk repræsentation af ændringer i blodets iltniveauer under forskellige forhold., Formålet med denne illustration er at konceptualisere forskellen mellem fysiologisk rangering og den hypo .emiske virkning af fysiologisk rangering. Jeg, II, og III illustrerer ændringer hos en normal person, der kontraherer pneumonitis, der forårsager en betydelig stigning i intrapulmonal rangering uden nogen kompenserende fysiologisk ændring., Status fra normal til akut lungebetændelse viser: ingen ændring i Niveau C på grund af ventilation og FIO2 er uændret, en bestemt fald i Niveau på grund af øget rangering skabt af lungebetændelse, og et fald i Niveau V, fordi AV indhold forskel er uændret (cardiac output og ilt forbrug er uændret). Da Diff N er steget i større grad end Diff D, øges den beregnede shunt. Tilstand 1 viser en øget hjerteproduktion (↑ ↑ ) som reaktion på den akutte hypo .æmi. Niveau C forbliver uændret, da hverken ventilation eller FIO2 er blevet ændret., Forskellen i AV-indhold er indsnævret, fordi hjerteproduktionen er steget, mens iltforbruget forbliver uændret. Stigningen i niveau V resulterer i en ny dynamisk ligevægt, hvor niveau A også øges. Bemærk, at forholdet mellem Diff N og Diff D kun ændres lidt. Således er niveau A (og derfor PaO2) steget med lidt ændring i den beregnede shunt. I dette tilfælde er kompensationen for hypo .æmi kardiovaskulær; den intrapulmonale shunt har ikke ændret sig. Tilstand II viser en øget inspireret iltkoncentration (FIO2↑)., Niveau C stiger, mens av-indholdsforskellen forbliver uændret (hjerteproduktion og iltforbrug uændret). En ny dynamisk ligevægt resulterer i niveau A (og derfor PaO2 stigende). Forholdet mellem Diff N og Diff D ændres kun lidt. Niveau A (og derfor PaO2) er steget med lidt ændring i den beregnede shunt. I dette tilfælde er kompensation for hypo .æmi via iltbehandling; den intrapulmonale shunt er i det væsentlige uændret. Tilstand III viser både minutvolumen og inspireret ilt koncentration ændringer (and and og FIO2 and)., Bemærk den dybe stigning i niveau A (og derfor PaO2) med ringe ændring i Diff N/Diff D. gengivet med tilladelse fra Elsevier Health Sciences.
alvorlig hypo .æmi vil normalt føre til en stigning i cardiacoutput. Dette resulterer i et fald i den arterielle-venøse o .ygenindhold forskel som afspejlet af en stigning inCvO2.
en ny ligevægt vil resultere i en stigning i CaO2 uden en ændring i forholdet (spsp / .t). Den arterielle Po2forbedrer sig meget uden en signifikant ændring i fysiologisk shuntsekundær på grund af en forbedret hjerteudgang.,
Hvis det antages, at supplerende ilt administreres til denne patient, mens hjertets output forbliver uændret, øges CcO2 sekundært til en øget alveolær PO2. Da de fysiologiske shuntremains den samme, og arteriel-venøs ilt indhold differenceremains det samme, en ny ligevægt resultater inCaO2 og CvO2increasing.
endelig ændres omstændighederne for at skildre en patient medilt Terapi og en stigning i hjertets output.CaO2 stiger, fordi bothCcO2 og CvO2 stigning.Hypo .æmi forbedres, mens forholdet (spsp /tt)forbliver uændret.,
den fysiologiske shuntberegning kan pålideligt afspejle graden af gasudveksling, der kan henføres til intrapulmonal sygdom ellerintracardiac shunting uanset andre faktorer, der også kan spille en rolle.
fordi flere årsager til hypo .æmi hyppigtinddrages hos de kritisk syge, er evnen til at kvantificere graden af intrapulmonal patofysiologi et yderst vigtigt værktøj.
Sådan bestemmes shunt
den intrapulmonale shunt kan kun måles, nårbåde arterielle og pulmonale arterielle blodprøver er tilgængeligeog FIO2 er konstant., Katetre insertedinto det centrale venøse cirkulation, der ligger lige over thesuperior vena cava-krydset i højre atrium er i høj grad utilstrækkelig forshunt bestemmelser, fordi blodet trukket fra denne position willnot indeholder betydeligt umættede blod fra coronarysinus eller ringere vena cava.
blodprøver taget fra højreatrium udviser signifikant iltindholdsvariation på grund afkanalisering af blodgennemstrømning og bevægelse af kateterspidsen. Katetertips i højre ventrikel kan forårsage ventrikulær ektopi og udbytte variable iltindhold prøver., Blandede venøse prøver opnåsfra et lungearteriekateter.
normale værdier er en gennemsnitlig delvistryk af O2 i blandet venøst blod på 40 mmHg(SVO2 75 %).
hvis det overhovedet er muligt, bør patienten ikke stimuleres eller forstyrres i flere minutter før prøveudtagning. Der skal udvises forsigtighedfor at undgå luftvejssugning og andre procedurer i løbet af denne tidsperiode. Den arterielle og blandede venøse prøve skal trækkessamtidig. Der skal udvises omhu for at undgå prøveudtagningsfejl,især fra lungearteriekateteret.,
når blodprøverudtrækkes fra lungearterien, skal prøven trækkes langsomt, fordi hurtig aspiration kan resultere i, at lungekapillærblod blandes med lungearterieblod, hvilket forårsager dramatiskstigning i iltindhold .
Hurtige strøm af intravenøs fluidsvia et centralt vene-kateter eller mere proksimalt PA kateter portscan forurene blod, trukket fra den distale-porten PA catheterand forårsage fejlagtige hæmoglobin bestemmelser og ilt contentcalculations.
Cao2-og Cvo2-værdierne beregnes., Der bør ikke være mere end 1 g / dlforskel mellem hæmoglobinindholdet i de to prøver. Det anbefales at anvende et gennemsnit af de to til beregningerne, hvis forskellen er mere end 0,5 g/dL.
det anbefales atkulbriksyhæmoglobin måles eller antages at være 1,5 % . TheCcO2-værdien beregnes derefter ved at anvendegennemsnit eller arterielt hæmoglobinindhold og under forudsætning af, at det partielle tryk på O2 i kapillærlejet er lig medpao2. Hvis PaO2 erstørre end 150 mmHg, antages alt tilgængeligt hæmoglobin at væremættet.
sand shunt er ildfast mod iltbehandling., Dette resulterer i hvader kaldes”ildfast hypo .æmi”. Da ildfast hypo .æmi ikke reagerer på O .ygenbehandling, bør der søges andre midler tilforbedre arteriel iltning. Disse kan omfatte behandling af theunderlying patologi, anvendelse af Positive Ende ExpiratoryPressure (PEEP) behandling eller øge ilt indhold til maintainacceptable ilt.
de mest almindelige årsager til refraktorhypo .æmi er opdelt i hjerte og lunge., De mest almindeligepulmonale årsager er konsolideret pneumonitis, atelektase, neoplasma eller akut respiratorisk distress syndrom/akut lunginjury.
Shunt og PEEP
da sand shunt ikke reagerer på ilt, kan der anvendes positiveend ekspiratorisk tryk eller PEEP-terapi på syge lunger for at reducere QSP /tt. Blandt de fysiologiske reaktioner, der ses med PEEP, er forbedret iltning, øget funktionel restkapacitet, forbedret lungekompliance og et fald i rangering.,
faldet i shunting set med PEEPis mest klassisk tilskrives alveolær rekruttering eller en stigning i funktionel restkapacitet sekundært til opblæsningen af tidligere kollapsede alveoler . Gattinoni har ved hjælp af computertomografi beskrevet den regionale gasfordeling i væv under titreringen af PEEP . Disse undersøgelser har bekræftet det klassiske bøjningspunkt i gas / vævskurven, som er i overensstemmelse med alveolær rekruttering .
responsen af PEEPtitration varierer ikke kun med typen af lungepatologi, men ogsåmed den undersøgte lunge region., Mere afhængige lunge regionsundergo større grader af alveolære rekruttering, mens lessdependent lunge regioner har tendens til at opleve større stigninger inalveolar volumen uden ansættelse, og områder af lungen, at arenon lydhør over for PEEP er ligeligt fordelt over hele lungen.
andre metoder til forbedring af iltning omfatter tilbøjelig positionering, hvilket øger homogeniteten af den intrapulmonale proces ogforbedrer ventilation .