Hvordan virker en buffer?
En buffer er i stand til at modstå pH-ændring, fordi de to komponenter (konjugerede syre og konjugerede base) er både til stede i større mængder ved ligevægt, og er i stand til at neutralisere små mængder af andre syrer og baser (i form af H3O+ og OH -), når det er føjet til den løsning. For at afklare denne effekt kan vi overveje det enkle eksempel på en flussyre (HF) og natriumfluorid (NaF) buffer., Flussyre er en svag syre på grund af den stærke tiltrækning mellem de relativt små f – ion og solvated protoner (H3O+), som ikke tillader det at dissociere fuldstændigt i vand. Derfor, hvis vi får HF i en vandig opløsning, opstiller vi følgende ligevægt med kun lille dissociation (Ka(HF) = 6.6×10-4, kraftigt favoriserer reaktanter):
\
Vi kan så tilføje og opløsning af natriumfluorid i løsningen, og blande de to, indtil vi når frem til det ønskede volumen-og pH-værdi, som vi ønsker at buffer., Når natriumfluorid opløses i vand, går reaktionen til færdiggørelse, således opnår vi:
\
da Na+ er konjugatet af en stærk base, vil det ikke have nogen effekt på bufferens pH eller reaktivitet. Tilsætningen af \(NaF\) til opløsningen vil imidlertid øge koncentrationen af F – i bufferopløsningen og følgelig ved Le Chateliers princip føre til lidt mindre dissociation af HF i den foregående ligevægt. Tilstedeværelsen af betydelige mængder af både konjugatsyren, \(HF\) og konjugatbasen, F-, tillader opløsningen at fungere som en buffer., Denne buffervirkning kan ses i titreringskurven for en bufferopløsning.
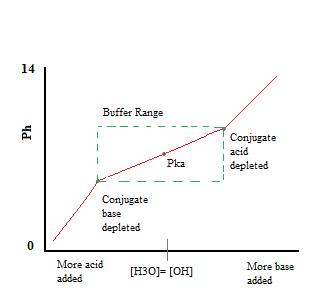
Som vi kan se, over bufferens arbejdsområde. pH ændres meget lidt med tilsætning af syre eller base. Når bufferkapaciteten er overskredet, springer ph-ændringen hurtigt. Dette sker, fordi konjugatsyren eller basen er udtømt gennem neutralisering. Dette princip indebærer, at en større mængde konjugatsyre eller base vil have en større bufferkapacitet.,
Hvis syren er blevet tilføjet:
\
I denne reaktion, den konjugerede base, F-, vil neutralisere den ekstra syre, H3O+, og denne reaktion går til afslutning, fordi reaktionen fra F – med H3O+ har en balance konstant meget større end én. (Faktisk ligevægtskonstanten reaktionen som skrevet er bare den omvendte af Ka for HF: 1/Ka(HF) = 1 / (6, 6 .10-4) = 1, 5 .10+3.,), Så længe der er flere F – end H3O+, næsten alle af H3O+ vil blive forbrugt og ligevægten forskydes mod højre, svagt stigende koncentration af HF og lidt faldende koncentration af F-, men resulterer i næsten enhver ændring i mængden af H3O+ stede, når ligevægt er genoprettet.,
Hvis base er blevet tilføjet:
\
I denne reaktion, den konjugerede syre, HF, vil neutralisere tilføjet mængder af base, ÅH-, og den balance vil igen skift til højre, svagt stigende koncentration af F – i-løsning og reducere mængden af HF lidt. Igen, da det meste af OH-neutraliseres, vil der forekomme lidt pH-ændring.
disse to reaktioner kan fortsætte med at skifte frem og tilbage med lidt pH-ændring.