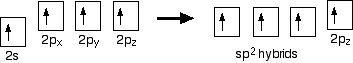en simpel visning af dobbelt kovalente bindinger
en dobbelt kovalent binding er, hvor to par elektroner deles mellem atomerne i stedet for kun et par.
nogle enkle molekyler indeholdende dobbeltbindinger
o Oxygenygen, O2
to O oxygenygenatomer kan begge opnå stabile strukturer ved at dele to par elektroner som i diagrammet.
dobbeltbindingen vises konventionelt ved to linjer, der forbinder atomerne. Hver linje repræsenterer et par delte elektroner.,
kuldioxid (CO2
Ethene, C2H4
Ethene har en dobbeltbinding mellem to kulstofatomer.
En mere nuanceret opfattelse af binding i ethene
Det er vigtigt at udforske binding i ethene mere detaljeret, fordi det har en direkte indflydelse på dens kemi. Medmindre du har en vis forståelse af den sande natur af dobbeltbindingen, kan du ikke rigtig forstå den måde, ethen opfører sig på.,
et orbitalbillede af bindingen i ethen
ethen er bygget ud fra hydrogenatomer (1s1) og carbonatomer (1s22s22p .12py1).
fremme af en elektron
carbonatomet har ikke nok uparrede elektroner til at danne det krævede antal bindinger, så det er nødvendigt at fremme et af 2s2-parret i den tomme 2P. – orbital. Dette er nøjagtigt det samme som sker, når kulstof danner bindinger – uanset hvad det ellers ender med at blive tilsluttet.
carbonatomet er nu i en ophidset tilstand.,
hybridisering
i tilfælde af ethen er der en forskel fra methan, fordi hvert kulstof kun forbinder til tre andre atomer snarere end fire. Når carbonatomerne hybridiserer deres ydre orbitaler, før de danner bindinger, hybridiserer de kun tre af orbitalerne snarere end alle fire. De bruger 2s-elektronen og to af 2p-elektronerne, men lader den anden 2p-elektron være uændret.