En syre-base – (proton transfer) reaktion
Til vores første eksempel på den kemiske reaktion, lad os se på en meget simpel reaktion, der opstår mellem hydroxid-ion-og saltsyre:
HCl+OH^- \Rightarrow H_20+Cl^-
Dette er en syre-base reaktion: en proton er overført fra HCl, syre, til hydroxid, base. Produktet er vand (konjugatsyren af hydro .id) og chloridion (konjugatbasen af HCl)., Du har utvivlsomt set denne reaktion før i generel kemi. På trods af sin enkelhed (og på trods af det faktum, at reaktanter og produkter er uorganiske snarere end økologisk), denne reaktion giver os mulighed for at overveje, for første gang mange af de grundlæggende idéer i organisk kemi, som vi vil udforske i forskellige sammenhænge i hele denne tekst.nøglen til at forstå næsten enhver reaktionsmekanisme er begrebet elektrondensitet, og hvordan det er forbundet med elektronbevægelsen (bindingsbrud og bindingsdannelse), der forekommer i en reaktion., Den hydroxid-ion – specielt, elektronegative ilt-atom i hydroxid-ion – har høj elektron densitet på grund af negativ ladning og polaritet af brint-ilt bond. Hydro oxygenid o oxygenygen er elektronrig.

hydrogenatomet i HCl har på den anden side Lav elektrondensitet: det er elektronfattigt. Som man kunne forvente, er noget, der er elektronrig, tiltrukket af noget, der er elektronfattigt., Når hydro .id og HCl bevæger sig tættere på hinanden, tiltrækkes et ensomt par elektroner på det elektronrige hydro .ido .ygen af den elektronfattige Proton af HCl, og elektronbevægelse forekommer mod protonen. De to elektroner i hydrogen-chlor sigma-bindingen frastødes af denne nærliggende hydro .idelektrontæthed og bevæger sig derfor endnu længere væk fra protonen og mod klorkernen., Konsekvensen af al denne elektronbevægelse er, at hydrogen-klorbindingen brydes, da de to elektroner fra denne binding helt bryder fri fra 1s-orbital af brintet og bliver et ensomt par i 3p-orbital af en chloridanion.
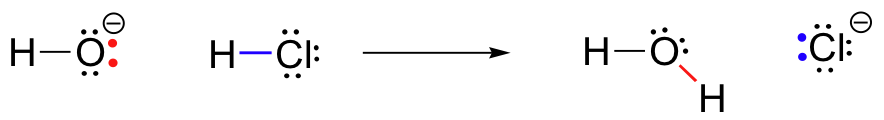
På samme tid, at brint-klor bond er ved at bryde, en ny sigma bond-former mellem brint og ilt, der indeholder de to elektroner, som tidligere var en enlig par på hydroxid. Resultatet af denne bindingsdannelse er naturligvis et vandmolekyle.
tidligere (afsnit 6. 1.,), så vi, hvordan buede pile blev brugt til at skildre elektronbevægelse, der forekommer i kemiske reaktioner, hvor bindinger brydes og nye bindinger dannes. HCl + OH-reaktionen er for eksempel afbildet ved at tegne to buede pile.
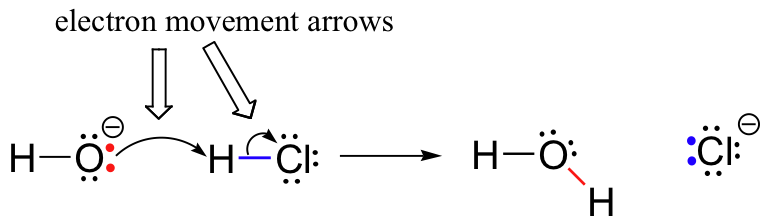
Den første pil oprindelse på en af de enlige par på hydroxid ilt og peger på, at ‘H’ – symbol i hydrogenbromid molekyle, der illustrerer de ‘angreb’ af ilt enlige par og efterfølgende dannelse af nye brint-ilt bond., Den anden buede pil stammer fra hydrogen-brombindingen og peger på ‘br’ – symbolet, hvilket indikerer, at denne binding bryder-de to elektroner ‘forlader’ og bliver et ensomt par på bromidion.
det er meget vigtigt at understrege på dette tidspunkt, at disse buede, to-piggede pile altid repræsenterer bevægelsen af to elektroner. Det meste af denne bog vil blive afsat til beskrivelsen af reaktionsmekanismer, der involverer to-elektron bevægelse, så disse fuldhovedede pile bliver meget velkendte.,

i andet semester vil vi dog se på radikale reaktionsmekanismer, hvor enkeltelektronbevægelse forekommer. Til disse processer vil der blive anvendt en buet pil med enkelt pigtråd (‘fiskekrog’).
øvelse
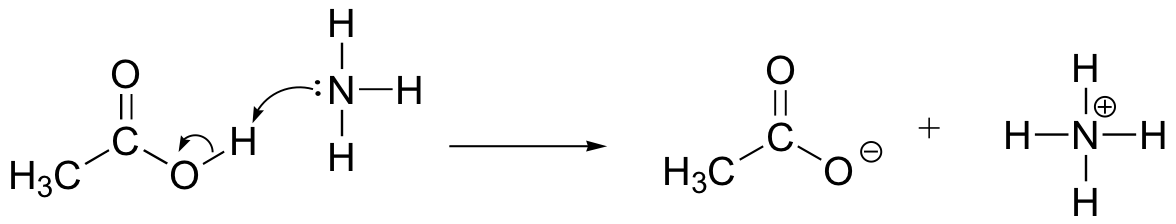
tegn elektronbevægelsespile for at illustrere syrebasereaktionen mellem eddikesyre, CH3COOH og ammoniak, NH3. Tegn de fulde Le .is strukturer af reaktanter og produkter.