Einführung
Das Verständnis und die Verwaltung von V / Q-Beziehungen stellt einen Eckpfeiler der Intensivstation (ICU) Patientenmanagement. Die V / Q-Beziehung (Abb. 1) kann als ein Spektrum zwischen gedacht werdenkopfraum (unendliches V/Q) und Shunt (Null V/Q).
Wenn pulmonares Kapillarblut einem alveolaren Partialdruck von ausgesetzt wirdoxygen (PAO2), Sauerstoffmoleküle bewegen sich als gelöstes O2 in Theplasma und üben weiterhin einen Teil ausdruck.,
Die meisten dieser Sauerstoffmoleküle verbinden sich sofort Mithämoglobin und treten in einen Zustand ein, in dem sie keinen Partialdruck mehr direkt ausüben. Dieser Prozess setzt sich fort, bis ein partieller Druckgradient zwischen der Alveole und dem Plasma nicht mehr existiert, an welchem Punkt das Hämoglobin für das BLUTPO2 maximal gesättigt ist.
Obwohl der im Plasmaprodukt gelöste Sauerstoff nur 1,5% bis 3% des gesamten Sauerstoffs im Blut ausmacht, ist der PO2-Wert wichtig, da er die Antriebskraft für die Sauerstoffbewegung in und aus dem Blut bestimmt.,
Ein perfekter Blutgasaustausch würde erfordern, dass jede Alveole perfekt belüftet und das gesamte Blut aus dem rechten Ventrikel ausgestoßen wird, um vollständig funktionsfähige Lungenkapillaren zu durchlaufen. Zusätzlich müsste die Diffusion über die Alveolar – / Kapillarmembran behindert werden.
Da das gesamte Blut, das vom rechten Ventrikel in den linken Ventrikel fließt, ein perfektes Gleichgewicht mit Alveolargas erreichen würde, wären das Alveolarpo2 (PAO2) und das arterielle PO2 (PaO2) identisch.
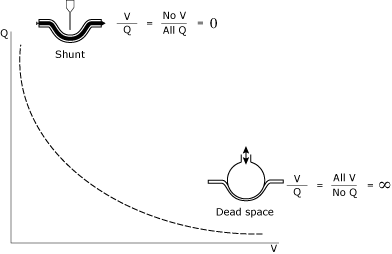
ABB. 1., Die mathematische und konzeptionelle Darstellung von Shunt und Deadspace.
Wie in Abb. 2, Sauerstoffversorgung in den normalen Lungen mayunterscheiden sich von der idealen Situation, weil die Verteilung der Perfusionis ungleichmäßig ist.
Relativ mehr Blutfluss findet in den schwerelosigkeitsabhängigen Bereichen statt, und eine gewisse venöse Drainage (von den bronchialen, pleuralen und thebesischen Venen) entleert sich direkt in diespalte Seite des Herzens, wodurch der normale Sauerstoffgenationsmechanismus umgangen (rangiert) wird .,
Aus diesem Grund gelangt etwas Blut in den linken Ventrikel mit einem niedrigeren Sauerstoffgehalt als das Blutveränderlich mit einer idealen Alveole. Abbildung 3 stellt den resultierenden niedrigeren PaO2-Wert im Vergleich zu der berechneten idealen Sauerstoffspannung dar.
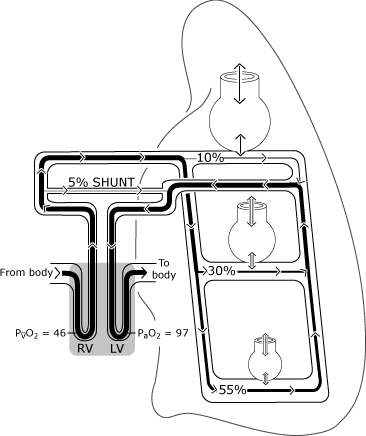
ABB. 2. Die normale Lunge hat eine unvollkommene Verteilung von Beatmung und Perfusion, die hauptsächlich durch die Schwerkraft bestimmt wird. Die Abbildung nimmt eine aufrechte Haltung ein, so dass sich die Lungenbasen in der schwerkraftabhängigen Position befinden., Die nicht gravitationsabhängigen Alveolen sind größer, erhalten aber weniger Gasaustausch (Belüftung) als die gravitationsabhängigen Alveolen. Die Verteilung der Perfusion wird hauptsächlich durch die Schwerkraft bestimmt, wobei ungefähr 55 % zu den schwerkraftabhängigen Bereichen, 30% zu den mittleren Lungenbereichen und 10% zu den nicht schwerkraftabhängigen Lungenbereichen fließen. PaO2 und PvO2 werden in mmHg ausgedrückt (kPa = mmHg × 0,133); RV = rechter Ventrikel; LV = linker Ventrikel. Reproduziert mit Genehmigung von Elsevier Health Sciences.
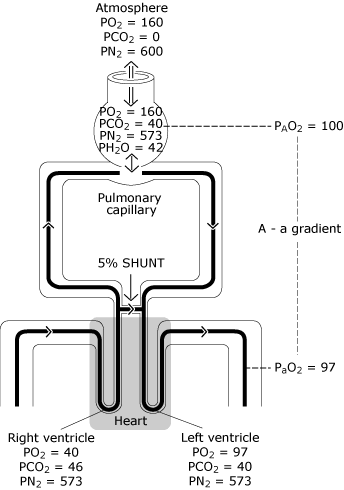
ABB. 3., Die normale Lunge hat eine unvollkommene Verteilung der Beatmung, eine unvollkommene Verteilung der Perfusion und einen minimalen Grad an intrapulmonalem Rangieren. Das Ergebnis ist eine Abnahme von PO2 vom berechneten idealen Alveolarwert (PAO2) auf den gemessenen systemischen arteriellen Blutwert (PaO2). Dieser PO2-Unterschied wird als „alveolar-arterieller Sauerstoffspannungsgradient“ bezeichnet . PO2 = Sauerstoffspannung ausgedrückt in mmHg; PCO2 = Kohlendioxidspannung ausgedrückt in mmHg; PN2 = Stickstoffspannung ausgedrückt in mmHg; PH2O = Wasserdampfspannung ausgedrückt in mmHg. (kPa = mmHg × 0.133)., Reproduziert mit Genehmigung von Elsevier Health Sciences.
Shunt und Hypoxämie
Anatomisches Shunting ist definiert als Blut, das von der rechten Sidezu der linken Seite des Herzens geht, ohne pulmonarycapillaries zu durchqueren. Kapillarshunt ist definiert als Blut, das von gehtdie rechte Seite des Herzens zur linken Seite des Herzens viapulmonale Kapillaren, die an unbelüftete Alveolen angrenzen.
In beiden Fällen kann Blut ohne Erhöhung des Sauerstoffgehalts in den linksseitigen Kreislauf gelangen., Dies wird als Null V/Q bezeichnet, oderwahres Rangieren, weil das Blut keine Gelegenheit zum Gasaustausch mit funktionellen Alveolen hatte.
Ein Beispiel für das Rangieren im klinischen Umfeld sind die Gasaustauschanomalien, die Inpneumonie durch die Freisetzung von Endotoxin, die zu Zellödemen und Vasokonstriktion führt .
Rangieren und Hypoxämie sind keine synonymen Begriffe, noch haben sie lineare Beziehungen. Die hypoxämische Wirkung eines Shunts wirdabhängig nicht nur von der Größe des Shunts, sondern auch von der Sauerstoffzufuhrstatus des venösen Blutes, das Shunts(SVO2)., Ein kleiner Shunt mit einem niedrigen SvO2 kann tiefgreifende hypoxämische Wirkungen haben,wohingegen ein großer Shunt mit einem hohen SvO2 eine weniger signifikante Hypoxämie verursachen wird.
Es kann eindeutig festgestellt werden, dass bei Vorliegen einer Hypoxämie ein gewisses Maß an Rangieren (intrapulmonal oder intrakardial) vorhanden sein muss; Die Wirkung von Shunt auf das Herz hängt jedoch stark von der kardiovaskulären Funktion und der Stoffwechselrate ab. Arterielle Hypoxämie ist eine Folge von Lungenfunktion, Herz-Kreislauf-Funktion und Stoffwechsel.,
Die Beurteilung des Sauerstoffgehalts ist für die Versorgung vieler Patienten, die eine kardiopulmonale unterstützende Behandlung benötigen, unerlässlich. Berechnung vonintrapulmonales Rangieren stellt das beste verfügbare Mittel dar, um das Ausmaß abzugrenzen, in dem das Lungensystem beiträgt ZUHYPOXÄMIE.
Intrapulmonaler Shunt
Wie bereits erwähnt, ist der intrapulmonale Shunt definiert als das Verhältnis des Herzzeitvolumens, das in die linke Seite des Herzens eindringt, ohne einen perfekten Gasaustausch mit vollständig funktionellenveolen. Intrapulmonaler Shunt kann in drei unterteilt werdenKomponenten.,
- Anatomisches Shunting wurde zuvor als Blut beschrieben, das in die linke Seite des Herzens gelangt, ohne die Lungenkapillaren zu durchqueren. Zusätzlich zum normalen anatomischen Shunting aus Bronchial -, Pleura-und Thebesian-Venen kann das anatomische Shunting durch vaskuläre Lungentumoren und intrakardiale Shunts von rechts nach links erhöht werden.
- Kapillarshunt wird verursacht, wenn Blut Lungenkapillaren durchquert, aber aufgrund pathologischer Prozesse wie Atelektase, Lungenentzündung und akuter Lungenverletzung nicht mit Alveolargas ausgeglichen wird.,
- Eine venöse Beimischung tritt auf, wenn sich das Blut mit einem alveolären PO2 ausgleicht, das weniger als ideal ist, wie in Situationen mit niedrigem V/Q. Da die venöse Beimischung kein echter Shunt ist, führt dies manchmal zu Verwirrung. Die Summe der anatomischen und kapillaren Shunts wird am häufigsten als Zero V/Q oder True Shunt bezeichnet. Venöse Beimischung wird oft als niedriger V/Q oder „Shunt-Effekt“bezeichnet. Physiologischer Shunt in normalen oder nicht erkrankten Lungen ist eine Messung des normalen intrapulmonalen Shunts. Im Rahmen der Lungenpathologie stellt der physiologische Shunt in erster Linie die Schwere des Krankheitszustands dar.,
Die Shuntgleichung
Die zur Berechnung des Shuntanteils des Herzzeitvolumens verwendete Gleichung geht davon aus, dass das Nicht-Shunt-Gas durch Austausch mit perfektem Alveolargas perfekt sauerstoffreich ist.
Obwohl das Konzept des intrapulmonalen Shunts nicht die regionalen Zusammenhänge widerspiegelt, wie auch das Konzept der Beatmungsperfusion, spiegelt es nicht wider, inwieweit die Lunge vom Ideal als Sauerstoffgenator des Lungenbluts abweicht.
Es ist diese quantitative Fähigkeit, die Lunge als Oxygenator zu betrachten, die diese Messungeinheitlich und wertvoll im klinischen Umfeld macht., Diese Überprüfung verwendet dieterm physiologischer Shunt in Bezug auf den intrapulmonalen Shuntberechnet mit dem Patienten, der weniger als 100% Sauerstoff atmet.
Die Ableitung der Shunt-Gleichung kommt von den Konzepten ofFick. Im Jahr 1870 führte er die klassische Beziehung ein, dass die Menge an Sauerstoff, die für die Gewebeverwertung pro Zeiteinheit verfügbar ist, den arteriellen Sauerstoffgehalt (CaO2)multipliziert mit der Menge an arteriellem Blut, die den Ergebnissen pro Zeiteinheit präsentiert wird (d. H. Herzzeitvolumen, Qt).,
Gleichung 1:
Sauerstoff verfügbar =(Qt)(CaO2)
Sauerstoff, der in die Lunge zurückgeführt wird, umfasst das Herzzeitvolumen(Qt) multipliziert mit dem gemischten venösen Sauerstoffgehalt(CVO2).
Gleichung 2:
Sauerstoffverbrauch =(Qt)(CvO2)
Sauerstoffverbrauch pro Zeiteinheit (VO2) sollte reflektierender Sauerstoff, der in diesem Zeitraum aus dem Blut gewonnen wurde.,
Gleichung 3:
VO2 = (Qt)(CaO2)– (Qt)(CvO2)
Gleichung 3 kann dann als klassischbeschriebene Fick-Gleichung neu geschrieben werden.
Gleichung 4:
VO2 = Qt(CaO2 –CvO2)
Algebraisch neu angeordnet, Gleichung 4 kann als eine Funktion des Herzzeitvolumens ausgedrückt werden.,
Gleichung 5:
Qt = VO2/(CaO2 –CvO2)(10)
Um die Herzleistung in Litern pro Minute auszudrücken, muss die Oxygendifferenz mit dem Faktor 10 multipliziert werden.
Zwei weitere Gleichungen, mit denen man sich vertraut machen muss, sind dieklassische Shuntgleichung (Gleichung 6), die den Ratiobetween shunted cardiac output und total cardiac output(QS/Qt) beschreibt. Es wird mit dem Patienten gemessenbehandlung 100 % Sauerstoff.,
Gleichung 6:
QS/Qt = (CcO2 –CaO2)/(CcO2 –CvO2)
Die physiologische shunt Gleichung (QSP/Qt) isanother Ausdruck für die Gleichung 6, gemessen mit der patientbreathing weniger als 100 % Sauerstoff und einige venöse Beimischung besteht.Die physiologische Shuntgleichung lautet daher:
Gleichung 7:
QSP/Qt = (CcO2 –CaO2)/ (CcO2 –CvO2)
Der QSP/Qt hat den Vorteil, dass er als Verhältnis erhalten wird, so dass kein absolutes Maß des Herzzeitvolumens erforderlich ist., In dieser Form zeigt die Gleichung deutlich, dass, alsdas gemietete Herzzeitvolumen nähert sich Null, der arterielle Sauerstoffcontent muss sich dem theoretischen Ende nähern Lungenkapillarsauerstoffgehalt.
Solange sich ein Teil des Herzzeitvolumens nicht perfekt mit perfekten Alveolen austauscht, muss die arterielle Sauerstoffzufuhr geringer sein als die ideale lungenkapillare Sauerstoffzufuhr.
Die Auswirkungen der physiologischen shunt-Gleichung beconceptualized unter Berücksichtigung der Sauerstoffgehalt Geschäftsbedingungen(CcO2, CaO2,CvO2), die als Entitäten, die können gegossen werden in acontainer (Abb. 4)., Bestimmte Faktoren, wie Hämoglobinkonzentration, kann alle drei Ebenen beeinflussen.
Die wichtigste klinische Variable, die CcO2 beeinflusst, istfio2, während sowohl das Herzzeitvolumen als auch der Sauerstoffverbrauch CvO2 beeinflussen. Änderungen inder physiologische Shunt beeinflussen CaO2.
ABB. 4. Schematische Darstellung des Blutsauerstoffspiegels, der theoretisch von drei verschiedenen Stellen im Herz-Kreislauf-System erhalten werden könnte. Level C repräsentiert den End-pulmonalen Kapillarblutsauerstoffgehalt (CcO2)., Level A repräsentiert den systemischen arteriellen Blutsauerstoffgehalt (CaO2) und Level V den gemischten venösen (Lungenarterie) Blutsauerstoffgehalt (CvO2). Die häufigsten klinischen Variablen, die diese verschiedenen Ebenen spezifisch beeinflussen, werden gezeigt: Ebene C wird am häufigsten durch Änderungen in FIO2 (die Sauerstofffraktion) beeinflusst, Ebene A wird spezifisch durch Änderungen im physiologischen Shunt (QSP) beeinflusst, Ebene V wird spezifisch sowohl durch das gesamte Herzzeitvolumen (QT) als auch durch die Rate des Sauerstoffverbrauchs (VO2) beeinflusst. Reproduziert mit Genehmigung von Elsevier Health Sciences.,
Der Zähler der Shuntgleichung wird dargestelltunterschiede in CcO2 undCaO2. Der Nenner der Gleichung istrepräsentiert durch die Unterschiede in CcO2 undCvO2.
Änderungen ungleicher Größen unterDiese drei Ebenen ändern das Verhältnis, was gleichbedeutend mitÄnderungen in der physiologischen Shunt-Berechnung.
Wenn sich ein Patient entwickeltulminante Rechts -, Mittel – und Unterlappenkonsolidierung, Diearterial-und Lungenarterienblutgasmessungen würden einklinisches Bild ergeben, wie in Abb. 5.,
Die arterielle Sauerstoffversorgung und der Gehalt sind aufgrund eines großen intrapulmonalen Shunts signifikant verringert. Wenn das Herzzeitvolumen unverändert bleibt undDie arteriell-gemischte venöse Sauerstoffdifferenz ändert sich nicht, dannder CvO2 muss ebenfalls abnehmen.
Aufgrund der ungleichen Größenordnung wird der physiologische Shunt sekundär zur Hypoxämie stark zunehmen.
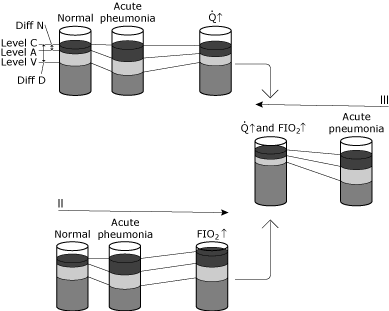
ABB. 5. Schematische Darstellung von Veränderungen des Blutsauerstoffspiegels unter verschiedenen Bedingungen., Der Zweck dieser Darstellung ist zu konzeptualisieren der Unterschied zwischen physiologischen Rangier-und hypoxemic Wirkung der physiologischen rangieren. I, II und III veranschaulichen Veränderungen bei einer normalen Person, die an einer Pneumonitis leidet, die einen signifikanten Anstieg des intrapulmonalen Rangierens ohne kompensatorische physiologische Veränderung verursacht., Der Status von normaler zu akuter Pneumonie zeigt: keine Änderung des Niveaus C, da Beatmung und FIO2 unverändert sind, einen spezifischen Abfall des Niveaus A aufgrund eines erhöhten Rangierens, das durch die Lungenentzündung verursacht wird, und einen Abfall des Niveaus V, weil der AV-Gehaltsunterschied unverändert ist (Herzzeitvolumen und Sauerstoffverbrauch unverändert). Da Diff N stärker zugenommen hat als Diff D, erhöht sich der berechnete Shunt. Zustand 1 zeigt ein erhöhtes Herzzeitvolumen (Q↑) als Reaktion auf die akute Hypoxämie. Level C bleibt unverändert, da weder die Belüftung noch FIO2 verändert wurden., Der AV-Gehaltsunterschied hat sich verringert, weil das Herzzeitvolumen zugenommen hat, während der Sauerstoffverbrauch unverändert bleibt. Die Erhöhung der Stufe V führt zu einem neuen dynamischen Gleichgewicht, in dem auch die Stufe A erhöht wird. Beachten Sie, dass die Beziehung zwischen Diff N und Diff D nur geringfügig geändert wird. Somit hat Level A (und damit der PaO2) mit geringer Änderung des berechneten Shunts zugenommen. In diesem Fall ist die Kompensation für Hypoxämie kardiovaskulär; Der intrapulmonale Shunt hat sich nicht geändert. Bedingung II zeigt eine erhöhte inspirierte Sauerstoffkonzentration (FIO2↑)., Das Niveau C steigt, während der AV-Gehaltsunterschied unverändert bleibt (Herzzeitvolumen und Sauerstoffverbrauch unverändert). Ein neues dynamisches Gleichgewicht führt dazu, dass Level A (und damit das PaO2 zunimmt). Die Beziehung zwischen Diff N und Diff D ist nur geringfügig verändert. Level A (und damit PaO2) hat sich mit geringer Änderung des berechneten Shunts erhöht. In diesem Fall erfolgt die Kompensation der Hypoxämie über eine Sauerstofftherapie; Der intrapulmonale Shunt ist im Wesentlichen unverändert. Zustand III zeigt sowohl Änderungen des Herzzeitvolumens als auch der Sauerstoffkonzentration (Q↑ und FIO2↑)., Beachten Sie den tiefgreifenden Anstieg von Level A (und damit PaO2) mit geringen Änderungen im Diff N/Diff D. Reproduziert mit Genehmigung von Elsevier Health Sciences.
Eine schwere Hypoxämie führt in der Regel zu einem Anstieg des cardiacoutput. Dies führt zu einer Abnahme des arteriell-venösen Oxygencontent-Unterschieds, was sich in einem Anstieg widerspiegelt inCvO2.
Ein neues Gleichgewicht führt zu einer Erhöhung von CaO2 ohne Änderung des Verhältnisses (QSP / Qt). Die arterielle po2impliziert sich stark, ohne eine signifikante Veränderung der physiologischen shuntsekundär, aufgrund einer verbesserten Herzzeitleistung.,
Wenn davon ausgegangen wird, dass diesem Patienten zusätzlicher Sauerstoff verabreicht wird, während das Herzzeitvolumen unverändert bleibt, wird CcO2 sekundär zu einem erhöhten Alveolarpo2 erhöht. Da der physiologische Shuntremains den gleichen und der arteriell-venöse Sauerstoffgehalt differenceremains den gleichen, ein neues Gleichgewicht resultiert inCaO2 und CVO2ERHÖHUNG.
Schließlich werden die Umstände geändert, um einen Patienten mit Sauerstofftherapie und einer Erhöhung des Herzzeitvolumens darzustellen.CaO2 erhöht sich, weil sowohl CCO2 als auch CvO2 zunehmen.Die Hypoxämie verbessert sich, während das Verhältnis (QSP/QT)unverändert bleibt.,
Die physiologische Shunt-Berechnung kann unabhängig von anderen Faktoren, die ebenfalls eine Rolle spielen können, zuverlässig den Grad des Gasaustauschs widerspiegeln, der auf eine intrapulmonale Erkrankung oder ein intrakardiales Shunt zurückzuführen ist.
Da bei kritisch Kranken häufig mehrere Ursachen von Hypoxämie auftreten, ist die Quantifizierbarkeit des Grades der intrapulmonalen Pathophysiologie ein äußerst wichtiges Instrument.
So bestimmen Sie den Shunt
Der intrapulmonale Shunt kann nur gemessen werden, wennbehr arterielle und pulmonale arterielle Blutproben verfügbar sindund die FIO2 konstant ist., Katheter, die in den zentralen Venenkreislauf eingeführt werden, der knapp über dem oberen Vena cava-rechten Vorhofknotenpunkt liegt, sind weitgehend unzureichend für stumpfe Bestimmungen, da Blut, das aus dieser Position entnommen wird, nicht das signifikant entsättigte Blut aus dem Coronarysinus oder der Vena cava inferior enthält.
Blutproben, die aus dem rechten Atrium entnommen wurden, weisen aufgrund Vonkannierung des Blutflusses und Bewegung der Katheterspitze signifikante Abweichungen des Sauerstoffgehalts auf. Katheterspitzen im rechten Ventrikel können ventrikuläre Ektopie verursachen und variable Sauerstoffgehaltsproben ergeben., Gemischte venöse Proben werden erhaltenvon einem Lungenarterienkatheter.
Normalwerte sind ein mittlerer Teildruck von O2 im gemischten venösen Blut von 40 mmHg (SVO2 75 %).
Wenn überhaupt möglich, sollte der Patient vor der Entnahme einige Minuten lang nicht stimuliert oder gestört werden. Vorsicht ist geboten, um das Absaugen der Atemwege und andere Verfahren während dieser Zeitperiode zu vermeiden. Die arterielle und gemischte venöse Probe sollte gezogen werdensimultan. Es muss darauf geachtet werden,Probenahmefehler zu vermeiden, insbesondere am Lungenarterienkatheter.,
Wenn Blutproben aus der Lungenarterie entnommen werden, muss die Probe langsam entnommen werden, da eine rasche Aspiration dazu führen kann, dass Lungenkapillarblut mit Lungenarterienblut vermischt wird, was zu dramatischen Erhöhungen des Sauerstoffgehalts führt .
Schneller Fluss intravenöser Fluidsvia ein zentraler Venenkatheter oder mehr proximale PA-Katheterportscan verunreinigen Blut aus dem distalen Port des PA-Katheters gezogen und verursachen fehlerhafte Hämoglobin-Bestimmungen und Sauerstoffgehaltskalkulationen.
Die CaO2-und CVO2-Werte werden berechnet., Es sollte nicht mehr als 1 g / DLUNTERSCHIED zwischen dem Hämoglobingehalt der beiden Proben. Ein Durchschnitt der beiden wird für die Berechnungen empfohlen, wenn Diedifferenz mehr als 0,5 g/dl beträgt.
Es wird empfohlen, das Carboxyhämoglobin zu messen oder als 1,5 % anzunehmen . Der CO2-Wert wird dann unter Verwendung des Durchschnitts-oder arteriellen Hämoglobingehalts berechnet und unter der Annahme, dass der Teildruck von O2 im Kapillarbett gleich demPaO2 ist. Wenn die PaO2 istgroßer als 150 mmHg, wird angenommen, dass alle verfügbaren Hämoglobin ungesättigt sind.
True Shunt ist refraktär zur Sauerstofftherapie., Dies führt zu einer sogenannten „refraktären Hypoxämie“. Da refraktäre Hypoxämie nicht auf Sauerstofftherapie anspricht, sollten andere Mittel gesucht werdenVerbesserung der arteriellen Sauerstoffversorgung. Dazu können die Behandlung der zugrunde liegenden Pathologie, die Anwendung der PEEP-Therapie (Positive End Exspiratorypressure) oder die Erhöhung des Sauerstoffgehalts gehören, um die Sauerstoffzufuhr aufrechtzuerhalten.
Die häufigsten Ursachen für Refraktorhypoxämie sind in Herz-und Lungenerkrankungen unterteilt., Die häufigstenpulmonale Ursachen sind konsolidierte Pneumonitis, Atelektase, Neoplasma oder das akute Atemnotsyndrom/akuter Lunginjury.
Shunt and PEEP
Da true Shunt nicht sauerstoffempfindlich ist, kann eine positive exspiratorische Druck-oder PEEP-Therapie auf die erkrankte Lunge angewendet werden, um die QSP / QT zu reduzieren. Zu den physiologischen Reaktionen, die mit PEEP beobachtet werden, gehören eine verbesserte Sauerstoffversorgung, eine erhöhte funktionelle Restkapazität, eine verbesserte Lungenkonformität und eine Abnahme des Rangierens.,
Die Abnahme des Rangierens, die bei PEEP beobachtet wird, wird am klassischsten auf Alveolarrekrutierung oder eine Zunahme der funktionellen Restkapazität als Folge der Inflationvon zuvor kollabierten Alveolen zurückgeführt .
Gattinoni hat mittels Computertomographie die regionale Gasverteilung in Geweben während der Titration von PEEP beschrieben . Diese Studien haben den klassizistischen Wendepunkt in der Gas – /Gewebekurve bestätigt, der bei der Alveolarrekrutierung konstant ist .
Die Reaktion der PEEPtitration variiert nicht nur mit der Art der Lungenpathologie, sondern auchmit der Region der untersuchten Lunge., Mehr abhängige Lungenregionen gehen von einem höheren Grad an Alveolarrekrutierung aus, während weniger abhängige Lungenregionen tendenziell einen stärkeren Anstieg des Alveolarvolumens ohne Rekrutierung erfahren, und Lungenregionen, die nicht auf PEEP reagieren, sind gleichmäßig in der Lunge verteilt.
Andere Methoden zur Verbesserung der Sauerstoffversorgung umfassen die Positionierung des Patienten, was die Homogenität des intrapulmonalen Prozesses erhöht undverbessert die Belüftung .