Wie funktioniert ein Puffer?
Ein Puffer ist in der Lage, pH-Veränderungen zu widerstehen, da die beiden Komponenten (Konjugatsäure und konjugierte Base) beide in nennenswerten Mengen im Gleichgewicht vorhanden sind und kleine Mengen anderer Säuren und Basen (in Form von H3O+ und OH -) neutralisieren können, wenn sie der Lösung zugesetzt werden. Um diesen Effekt zu verdeutlichen, können wir das einfache Beispiel eines Flusssäure – (HF) und Natriumfluorid – (NaF) – Puffers betrachten., Flusssäure ist eine schwache Säure aufgrund der starken Anziehungskraft zwischen dem relativ kleinen F-Ion und den gelösten Protonen (H3O+), die es nicht erlaubt, sich vollständig in Wasser zu dissoziieren. Wenn wir HF in einer wässrigen Lösung erhalten, stellen wir daher das folgende Gleichgewicht mit nur geringer Dissoziation her (Ka(HF) = 6, 6×10-4, stark begünstigt Reaktanten):
\
Wir können dann Natriumfluorid zu der Lösung hinzufügen und auflösen und die beiden mischen, bis wir das gewünschte Volumen und den gewünschten pH-Wert erreichen, bei dem wir puffern möchten., Wenn sich Natriumfluorid in Wasser auflöst, ist die Reaktion abgeschlossen, so erhalten wir:
\
Da Na+ das Konjugat einer starken Base ist, hat es keinen Einfluss auf den pH-Wert oder die Reaktivität des Puffers. Die Zugabe von \(NaF\) zu der Lösung erhöht jedoch die Konzentration von F – in der Pufferlösung und führt folglich nach Le Chateliers Prinzip auch im vorherigen Gleichgewicht zu einer etwas geringeren Dissoziation des HF. Das Vorhandensein signifikanter Mengen sowohl der Konjugatsäure \(HF\) als auch der Konjugatbasis F-ermöglicht es der Lösung, als Puffer zu fungieren., Diese Pufferwirkung ist in der Titrationskurve einer Pufferlösung zu sehen.
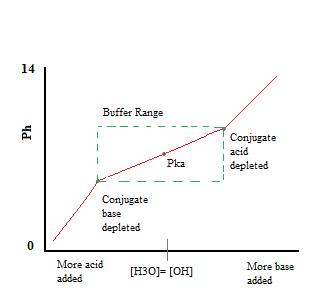
Wie wir sehen können, über dem Arbeitsbereich des Puffers. pH-Wert ändert sich sehr wenig mit der Zugabe von Säure oder base. Sobald die Pufferkapazität überschritten ist, springt die Rate der pH-Änderung schnell. Dies geschieht, weil die Konjugatsäure oder Base durch Neutralisation erschöpft ist. Dieses Prinzip impliziert, dass eine größere Menge Konjugatsäure oder Base eine größere Pufferkapazität aufweist.,
Wenn Säure hinzugefügt wurde:
\
In dieser Reaktion neutralisiert die konjugierte Base F-die hinzugefügte Säure H3O+, und diese Reaktion geht zu Ende, weil die Reaktion von F – mit H3O+ eine Gleichgewichtskonstante hat, die viel größer als eins ist. (Tatsächlich ist die Gleichgewichtskonstante der geschriebenen Reaktion nur die Umkehrung des Ka für HF: 1 / Ka(HF) = 1/(6, 6×10-4) = 1, 5×10+3.,) Solange es mehr F-als H3O+ gibt, wird fast das gesamte H3O+ verbraucht und das Gleichgewicht verschiebt sich nach rechts, wodurch die HF-Konzentration leicht erhöht und die F-Konzentration leicht verringert wird, was jedoch zu kaum einer Änderung der Menge an H3O+ führt, die vorhanden ist, sobald das Gleichgewicht wiederhergestellt ist.,
Wenn Base hinzugefügt wurde:
\
Bei dieser Reaktion neutralisiert die Konjugatsäure HF zugesetzte Mengen an Base, OH -, und das Gleichgewicht verschiebt sich wieder nach rechts, wodurch die Konzentration von F – in der Lösung leicht erhöht und die Menge an HF leicht verringert wird. Auch hier, da die meisten der OH – neutralisiert wird, wird wenig pH-Änderung auftreten.
Diese beiden Reaktionen können sich mit wenig pH-Veränderung weiterhin hin und her abwechseln.