no todas las colisiones son iguales
para un gas a temperatura ambiente y presión atmosférica normal, hay alrededor de 1033 colisiones en cada centímetro cúbico de espacio cada segundo. Si cada colisión entre dos moléculas de reactivos produjera productos, todas las reacciones se completarían en una fracción de segundo. Por ejemplo, cuando dos bolas de billar chocan, simplemente rebotan entre sí., Este es el resultado más probable si la reacción entre A y B requiere una interrupción significativa o reordenamiento de los enlaces entre sus átomos. Para iniciar efectivamente una reacción, las colisiones deben ser lo suficientemente energéticas (o tener suficiente energía cinética) para provocar esta interrupción del enlace. Esto se analiza más adelante.
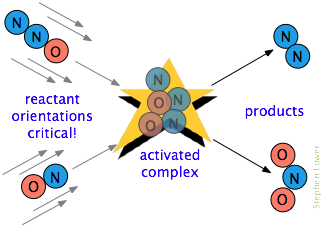
a menudo Hay un requisito adicional. En muchas reacciones, especialmente aquellas que involucran moléculas más complejas, las especies que reaccionan deben estar orientadas de una manera que sea apropiada para el proceso particular., Por ejemplo, en la reacción en fase gaseosa del óxido dinitrógeno con óxido nítrico, el extremo de oxígeno del N2O debe golpear el extremo de nitrógeno del NO; alterar la orientación de cualquiera de las moléculas evita la reacción. Debido a la extensa aleatorización de los movimientos moleculares en un gas o líquido, siempre hay suficientes moléculas orientadas correctamente para que algunas de las moléculas reaccionen. Sin embargo, cuanto más crítico sea este requisito orientativo, menos colisiones serán efectivas.,
Las Colisiones energéticas entre moléculas hacen que los enlaces interatómicos se estiren y doblen, debilitándolos temporalmente para que sean más susceptibles a la escisión. La distorsión de los enlaces puede exponer sus nubes de electrones asociadas a interacciones con otros reactivos que podrían conducir a la formación de nuevos enlaces.,
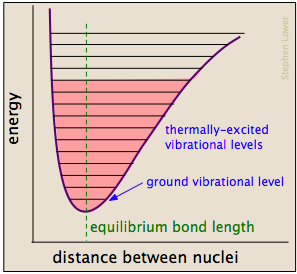
Los enlaces químicos tienen algunas de las propiedades de los resortes mecánicos: sus energías potenciales dependen de la medida en que se estiran o comprimen. Cada enlace átomo a átomo se puede describir mediante un diagrama de energía potencial que muestra cómo su energía cambia con su longitud., Cuando el enlace absorbe energía (ya sea por calentamiento o a través de una colisión), se eleva a un estado vibracional cuantizado más alto (indicado por las líneas horizontales) que debilita el enlace a medida que su longitud oscila entre los límites extendidos correspondientes a la curva.
una colisión particular típicamente excita un número de enlaces de esta manera. Dentro de unos 10-13 segundos, esta excitación se distribuye entre los otros enlaces en la molécula de maneras complejas e impredecibles que pueden concentrar la energía añadida en un punto particularmente vulnerable., El enlace afectado puede estirarse y doblarse más, lo que lo hace más susceptible a la escisión. Incluso si el enlace no se rompe por estiramiento puro, puede distorsionarse o torcerse para exponer las nubes de electrones cercanas a interacciones con otros reactivos que podrían alentar una reacción.