el óxido férrico, también llamado por su nombre IUPAC Trihidrato de hierro o óxido de hierro(III), es un compuesto inorgánico representado por la fórmula química Fe2O3 o Fe2H6O3 . Es uno de los óxidos de hierro más importantes, siendo los otros dos el óxido ferrooferrico (Fe3O4) y el óxido ferroso (FeO) respectivamente . Se produce naturalmente como la hematita mineral .,
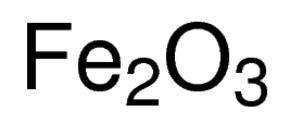
fórmula de óxido férrico
óxido férrico hidratado
es un compuesto gelatinoso de color marrón rojizo producido mediante la adición de álcali a soluciones que contienen sales de Fe(III). También se llama óxido férrico hidratado y puede representarse químicamente como Fe2O3.H2o o Fe(O)OH . Algunas formas comunes de la óxido férrico hidratado incluyen rojo lepidocrocita que se produce externamente en corroídas y naranja goethita que se produce en el interior de corroídas.,
cómo se prepara el óxido férrico
el óxido férrico se sintetiza en el laboratorio a través de la electrólisis de la solución de bicarbonato de sodio, que actúa como un electrolito inerte y un ánodo de hierro. La conversión electrolítica de hierro en óxido de hierro hidratado (III) se representa como:
4Fe + 3O2 + 2H2O → 4 FeO(OH)
el óxido de hierro hidratado (III), así producido, sufre deshidratación a alrededor de 200 °C para formar óxido férrico ., al sulfato ferroso (FeSO4), que se oxida aún más a Sulfato férrico :
- FeS2 + 7o+ H2O → FeSO4 + H2SO4
- 2feso4 + H2SO4 + o → Fe2(SO4)3 + H2O
El aluminio reemplaza el hierro del óxido férrico
El aluminio y el óxido férrico experimentan una reacción redox por la cual el metal reemplaza el hierro para formar aluminio óxido:
Fe2O3 + 2Al → Al2O3 + 2FE
propiedades y características del óxido férrico
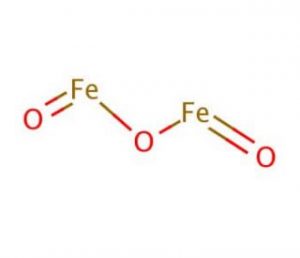
estructura del óxido férrico
usos
- en acero y aleaciones .,
- El polvo de óxido férrico, también llamado colorete de joyería, se utiliza para pulir lentes y joyas metálicas .
- Su forma granular se utiliza como medio de filtración para extraer fosfatos en acuarios de agua salada .
- Como pigmento marrón 6 y pigmento rojo 101 aprobados por la FDA, para uso en cosméticos .
- En aplicaciones biomédicas, porque sus nanopartículas no son tóxicas y biocompatibles .
¿es peligroso
la exposición prolongada a su humo o polvo puede provocar neumoconiosis con fiebre, escalofríos, dolores, dificultad para respirar y tos ., El contacto repetido con los ojos puede decolorarlo y causar manchas permanentes de hierro .óxido de hierro(III) Chemspider.com