configuración electrónica
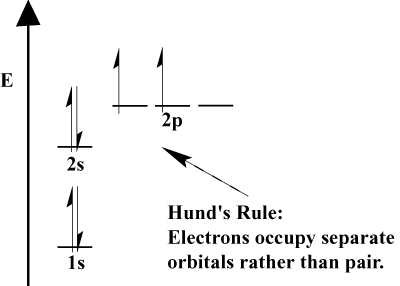
Los electrones en un átomo llenan sus orbitales atómicos de acuerdo con el principio Aufbau; «Aufbau», en alemán, significa «acumulación».»El principio de Aufbau, que incorpora el principio de exclusión de Pauli y la regla de Hund prescribe algunas reglas simples para determinar el orden en el que los electrones llenan los orbitales atómicos:
- Los electrones siempre llenan los orbitales de menor energía primero. 1s se llena antes de 2s, y 2s antes de 2p.,
- El principio de exclusión de Pauli establece que no hay dos electrones dentro de un átomo en particular que puedan tener números cuánticos idénticos. En función, Este principio significa que si dos electrones ocupan el mismo orbital, deben tener espín opuesto.
- La regla de Hund establece que cuando un electrón se une a un átomo y tiene que elegir entre dos o más orbitales de la misma energía, el electrón preferirá entrar en un orbital vacío en lugar de uno ya ocupado., A medida que se agregan más electrones al átomo, estos electrones tienden a llenar los orbitales de la misma energía antes de emparejarse con los electrones existentes para llenar los orbitales.
electrones de Valencia y Valencia
La capa orbital más externa de un átomo se llama su capa de Valencia, y los electrones en la capa de Valencia son electrones de Valencia. Los electrones de Valencia son los electrones de mayor energía en un átomo y, por lo tanto, son los más reactivos. Mientras que los electrones internos (aquellos que no están en la capa de Valencia) normalmente no participan en la unión química y las reacciones, los electrones de Valencia se pueden ganar, perder o compartir para formar enlaces químicos., Por esta razón, los elementos con el mismo número de electrones de Valencia tienden a tener propiedades químicas similares, ya que tienden a ganar, perder o compartir electrones de Valencia de la misma manera. La Tabla periódica fue diseñada con esta característica en mente. Cada elemento tiene un número de electrones de Valencia igual a su número de grupo en la Tabla periódica.
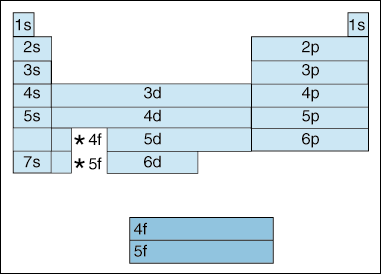
esta tabla ilustra una serie de características interesantes y complicadas de la configuración electrónica.,
primero, a medida que los electrones se vuelven más altos en energía, se produce un cambio. Hasta ahora, hemos dicho que a medida que aumenta el número cuántico principal, también aumenta el nivel de energía del orbital. Y, como dijimos anteriormente en el principio de Aufbau, los electrones llenan orbitales de menor energía antes de llenar orbitales de mayor energía. Sin embargo, el diagrama anterior muestra claramente que el orbital 4s se llena antes que el orbital 3d., En otras palabras, una vez que llegamos al principio del número cuántico 3, las subcapas más altas de los números cuánticos más bajos eclipsan en energía las subcapas más bajas de los números cuánticos más altos: 3d es de energía más alta que 4s.
segundo, lo anterior indica un método para describir un elemento de acuerdo con su configuración electrónica. A medida que se mueve de izquierda a derecha a través de la Tabla periódica, el diagrama anterior muestra el orden en que se llenan los orbitales. Si fuéramos realmente descomponer el diagrama anterior en grupos en lugar de los bloques que tenemos, mostraría exactamente cuántos electrones tiene cada elemento., Por ejemplo, el elemento de hidrógeno, ubicado en la esquina superior izquierda de la Tabla periódica, se describe como 1s1, con la s describiendo qué orbital contiene electrones y el 1 describiendo cuántos electrones residen en ese orbital. El litio, que reside en la Tabla periódica justo debajo del hidrógeno, se describiría como 1s22s1. Las configuraciones electrónicas de los primeros diez elementos se muestran a continuación (tenga en cuenta que los electrones de Valencia son el electrón en la capa de energía más alta, no solo los electrones en la subcapa de energía más alta).,

la regla del octeto
nuestra discusión de las configuraciones electrónicas de Valencia nos lleva a uno de los principios cardinales de la unión química, la regla del octeto. La regla del octeto establece que los átomos se vuelven especialmente estables cuando sus capas de Valencia obtienen un complemento completo de electrones de Valencia. Por ejemplo, en el ejemplo anterior, el helio (He) y el neón (Ne) tienen capas de Valencia externas que están completamente llenas, por lo que ninguno tiene una tendencia a ganar o perder electrones., Por lo tanto, el helio y el neón, dos de los llamados gases nobles, existen en forma atómica libre y no suelen formar enlaces químicos con otros átomos.
La mayoría de los elementos, sin embargo, no tienen una capa exterior completa y son demasiado inestables para existir como átomos libres. En su lugar, buscan llenar sus capas externas de electrones formando enlaces químicos con otros átomos y, por lo tanto, alcanzar la configuración de Gas Noble. Un elemento tenderá a tomar el camino más corto para lograr la configuración de Gas Noble, ya sea que eso signifique ganar o perder un electrón., Por ejemplo, el sodio (Na), que tiene un solo electrón en su orbital externo 3s, puede perder ese electrón para alcanzar la configuración electrónica del neón. El cloro, con siete electrones de Valencia, puede ganar un electrón para alcanzar la configuración de argón. Cuando dos elementos diferentes tienen la misma configuración electrónica, se llaman isoelectrónicos.
diamagnetismo y paramagnetismo
la configuración electrónica de un átomo también tiene consecuencias en su comportamiento en relación con los campos magnéticos. Tal comportamiento depende del número de electrones que tiene un átomo que están emparejados por espín., Recuerde que la regla de Hund y el principio de exclusión de Pauli se combinan para dictar que los orbitales de un átomo se llenarán a medias antes de comenzar a llenarse completamente, y que cuando se llenen completamente con dos electrones, esos dos electrones tendrán giros opuestos.
un átomo con todos sus orbitales llenos, y por lo tanto todos sus electrones emparejados con un electrón de espín opuesto, se verá muy poco afectado por los campos magnéticos. Tales átomos se llaman diagméticos. Por el contrario, los átomos paramagnéticos no tienen todos sus electrones spin-pareados y se ven afectados por los campos magnéticos., Hay grados de paramagnetismo, ya que un átomo puede tener un electrón no emparejado, o puede tener cuatro.