Introduction
Adipose-derived stromal cells (ASCs) are multipotent and immunoprivileged, making them ideal candidates for therapeutic purposes (Bourin et al., 2013; Ma et al., 2014; Kallmeyer y Pepper, 2015). Las ASCs se pueden aislar utilizando técnicas mínimamente invasivas de varios depósitos de tejido adiposo en el cuerpo (Zuk et al., 2001)., Se caracterizan por su capacidad para adherirse al plástico, un perfil de marcador de superficie único y la capacidad de diferenciarse en hueso, grasa y cartílago (Dominici et al., 2006; Bourin et al., 2013). Las ASCs comprenden ~15-30% de la fracción vascular estromal (SVF) del tejido adiposo (Bourin et al., 2013; Zuk, 2013), y necesitan expandirse ex vivo para obtener suficientes números celulares con fines terapéuticos.,
proporcionar productos de Terapia Celular seguros y regulados a los pacientes requiere la adhesión a las buenas prácticas de fabricación (GMP), y las pautas de GMP deben cumplirse a lo largo del proceso de aislamiento, expansión y diferenciación de ASCs (Giancola et al., 2012). Los numerosos reactivos utilizados para aislar y expandir ASCs con fines de investigación son de origen animal o no son de grado clínico; por lo tanto, estos deben reemplazarse con alternativas más adecuadas de acuerdo con las normas GMP (Halme y Kessler, 2006; Riis et al., 2015)., Revisamos la elección de la suplementación sérica que se puede utilizar para la expansión de ASC en lugar de suero bovino fetal (FBS), y describimos sus efectos in vitro e In vivo según lo reportado en la literatura.,
directrices y técnicas de la Sociedad Internacional de Terapia Celular (ISCT) y la Sociedad Internacional de tecnología aplicada a la grasa (IFATS) para evaluar las características de las células del estroma derivadas del tejido adiposo
La Sociedad Internacional de Terapia Celular (ISCT) y la Sociedad Internacional de tecnología aplicada a la grasa (IFATS) han recomendado un conjunto de criterios y directrices mínimos para la caracterización de las ASCs (Dominici et al., 2006; Bourin et al., 2013)., Estos criterios incluyen la capacidad de las ASCs para adherirse al plástico, su perfil de marcador de superficie y su potencial de diferenciación trilineal. El último documento de posición describe la viabilidad y la proliferación como mediciones adicionales a los criterios de caracterización originales. Además, se han definido métodos experimentales y ensayos para medir los criterios de caracterización (Bourin et al., 2013)., Estos criterios se han visto afectados por numerosos factores como la técnica de liposucción, la técnica de aislamiento de SVF y los medios y suplementación utilizados durante el proceso de expansión (Koellensperger et al., 2014; Bajek et al., 2015; Busser et al., 2015). De acuerdo con las directrices del ISCT y el IFATS, se recomienda y acepta la práctica de investigación para confirmar la adhesión a las directrices anteriores para cada condición de aislamiento y cultivo con el fin de clasificar la población celular resultante como ASCs.,
técnicas y métodos utilizados para caracterizar las ASCs
morfología y adherencia
Una vez sembradas, las ASCs adherentes muestran una morfología distinta, que puede describirse como delgadas, alargadas y en forma de huso. La evaluación morfológica de las ASCs suele realizarse mediante microscopía óptica (Trojahn Kølle et al., 2013).
proliferación
las directrices del ISCT y del IFATS han recomendado que la proliferación y la frecuencia de los ACSs progenitores se midan mediante un ensayo de unidad formadora de colonias fibroblastoides (Bourin et al., 2013)., Otras técnicas utilizadas en los estudios citados en esta revisión utilizan el recuento de células viables o la medición de la capacidad proliferativa de las ASCs mediante inmunohistoquímica. Los métodos de conteo incluyen (1) contar las células usando un tinte de viabilidad y un hemocitómetro, (2) contar las células usando cuentas de conteo o técnicas de tinción y análisis citométrico de flujo, y (3) Usar ensayos colorimétricos que miden células viables en un espectrofotómetro (Gharibi y Hughes, 2012; Trojahn Kølle et al., 2013; Bogdanova et al., 2014; Atashi et al., 2015; Johal et al., 2015; Oikonomopoulos et al., 2015).,
inmunofenotipo
Las guías ISCT e IFATS han enumerado la expresión de múltiples marcadores de superficie y sus porcentajes esperados como un requisito firme en su declaración de posición. También han recomendado que la expresión de marcadores de superficie debe medirse mediante tinción multicolor de anticuerpos (Bourin et al., 2013). Los estudios en esta revisión hicieron uso del análisis citométrico de flujo para medir la expresión de marcadores de superficie (Müller et al., 2006; Lindroos et al., 2009; Chieregato et al., 2011; Josh et al., 2012; Trojahn Kølle et al., 2013; Bogdanova et al., 2014; Patrikoski et al., 2014).,
diferenciación trilineal
tradicionalmente, la diferenciación en tejido adiposo, hueso y cartílago se ha medido utilizando técnicas de tinción histoquímica visualizadas bajo microscopía; sin embargo, las directrices del ISCT y el IFATS han recomendado que las evaluaciones cualitativas se reemplacen o complementen con enfoques cuantitativos, como medir la expresión de ARNm específica del linaje utilizando técnicas de reacción cuantitativa en cadena de la polimerasa con transcripción inversa (RT-qPCR) (Bourin et al., 2013)., Las técnicas que se han utilizado para medir la capacidad de diferenciación, descritas en los estudios citados en esta revisión, han variado desde la tinción histoquímica, hasta la PCR convencional y la RT-qPCR. Las técnicas de tinción histoquímica incluyen la tinción de las células con (1) rojo aceite O y rojo Nilo para la adipogénesis; (2) rojo alizarina s, fosfatasa alcalina y von Kossa para la osteogénesis; o (3) Azul Alciano y safranina para la condrogénesis (Müller et al., 2006; Kocaoemer et al., 2007; Hebert et al., 2010; Rajala et al., 2010; Koellensperger et al., 2014; Oikonomopoulos et al., 2015; Riis et al., 2016).,
suplementación sérica
suero bovino Fetal
FBS es el suplemento sérico tradicional utilizado para el cultivo celular. FBS contiene factores de crecimiento (GFs) y otros elementos esenciales para la fijación ASC, expansión, mantenimiento y proliferación in vitro (Lennon et al., 1995, 1996; Zuk et al., 2001; van der Valk et al., 2010). El FBS es propenso a la variación de lote a lote, xenoinmunización y posible contaminación con micoplasma, virus, endotoxinas y priones (van der Valk et al., 2004, 2010; Chieregato et al., 2011; Kyllonen et al., 2013; Jin et al., 2015)., La fuente y la calidad del FBS pueden afectar la proliferación y diferenciación de ASCs, y el cribado de rutina para micoplasma, endotoxinas y virus se ha vuelto importante (Naaijkens et al., 2012). Estos factores pueden afectar los resultados experimentales y hacer que el producto celular sea inseguro para el uso clínico (Zuk et al., 2001; van der Valk et al., 2004; Witzeneder et al., 2013).
Las ASCs son inmunoprivilegiadas, careciendo de la expresión del complejo de histocompatibilidad principal clase II, así como de moléculas coestimuladoras de células T y B (CD80, CD86 y CD40)., La inmunogenicidad in vitro y las propiedades inmunosupresoras de las ASCs generalmente se miden mediante el cocultivo de las ASCs con células mononucleares de sangre periférica en reacciones mixtas de linfocitos y midiendo la respuesta proliferativa de las células T (McIntosh et al., 2006; Patrikoski et al., 2014). Las ASCs demuestran propiedades inmunomoduladoras e inmunosupresoras, como lo demuestra su capacidad para regular la función de las células T y modular la secreción de citoquinas in vitro e in vivo (Leto Barone et al., 2013; Roemeling-van Rhijn et al., 2013; Patrikoski et al., 2014)., Estas propiedades surgen de la baja inmunogenicidad de las ASCs. La mayoría de los ensayos clínicos de ASC y otras células madre mesenquimales (MSC) (Fase I, II y III) utilizan medios suplementados con FBS, y se ha informado de que los efectos inmunogénicos son provocados por los componentes de FBS en sujetos humanos (Sundin et al., 2007; Riis et al., 2015). Por ejemplo, un ensayo clínico que utilizó MSCs derivadas de médula ósea (MSCs BM) expandidas en FBS encontró anticuerpos contra los componentes de FBS (Horwitz et al., 2002)., Se han notificado respuestas inmunes a FBS como Arthus y reacciones anafilácticas en ensayos clínicos, donde los pacientes fueron tratados con células dendríticas y linfocitos expuestos a FBS (Selvaggi et al., 1997; Mackensen et al., 2000). En contraste, un metanálisis de ensayos clínicos MSC encontró que más del 75% de los experimentos usaron FBS en sus protocolos de expansión celular y solo un estudio monitoreó y demostró reacciones adversas a FBS (Lalu et al., 2012)., Los estudios in vivo que examinaron la respuesta inmune de ratones a ASCs mostraron inmunosupresión e inmunomodulación conservadas, inmunogenicidad baja y ninguna reacción a FBS (Cho et al., 2009; González et al., 2009). Aunque las ASCs están siendo ampliamente probadas en ensayos clínicos, su uso definitivo como agente terapéutico aún está por establecerse. Esto se agrava aún más por el uso de modelos preclínicos que pueden no ser biológicamente relevantes (Monsarrat et al., 2016). Además, el FBS puede ser menos inmunogénico en ratones y otros modelos animales que en humanos., Finalmente, la respuesta inmune provocada por el FBS(Selvaggi et al., 1997; Mackensen et al., 2000; Horwitz et al., 2002) podría influir en el rechazo de las células trasplantadas en la terapia basada en células.
alternativas sin suero
la composición desconocida e indefinida de FBS es un inconveniente importante. Una alternativa preferible sería un medio químicamente definido con una composición conocida, como los medios libres de suero (SF) o XF disponibles comercialmente(Usta et al., 2014)., Se supone erróneamente que estos medios libres de suero carecen de cualquier producto animal, ya que los Términos SF y XF se utilizan a menudo indistintamente. Sin embargo, los medios de SF generalmente se suplementan con albúmina sérica humana o derivada de animales y GFs en cantidades indefinidas (Patrikoski et al., 2013). Los medios libres de Xeno, por otro lado, son medios químicamente definidos que contienen componentes bien definidos en concentraciones específicas (Usta et al., 2014).
factores de crecimiento
otra alternativa al suero es la adición de GFs al medio de cultivo, ya sea de forma aislada o como cóctel., Estos GFs pueden ser sintéticos, de origen animal o humano. El reemplazo con GFs sintéticos es preferible debido a su mayor calidad y como resultado de la estandarización entre lotes, lo que puede no ser posible para GFs de origen animal o humano. Los GFs comúnmente utilizados son el factor de crecimiento de fibroblastos, el factor de crecimiento epidérmico y el factor de crecimiento derivado de plaquetas (PDGF; Baer y Geiger, 2012; Ahearne et al., 2014). La adición de GFs se ha relacionado con un aumento en la proliferación (Hebert et al., 2010; Gharibi y Hughes, 2012)., Un potencial de diferenciación adipogénica mejorado ha sido reportado previamente en ASCs expandidas en medio suplementado con GF (Hebert et al., 2010). Sin embargo, otro estudio observó un efecto negativo en la diferenciación adipogénica y osteogénica en ASCs cultivadas a largo plazo (Gharibi y Hughes, 2012).
albúmina sérica
la albúmina sérica es una proteína plasmática abundante y puede aislarse de seres humanos y animales. A menudo, los medios de SF se complementan con albúmina sérica., Los estudios que comparan la albúmina sérica humana para la suplementación con ASC media han encontrado una mejor proliferación, una morfología más pequeña similar a un huso y una diferenciación preservada en adiposo, hueso y cartílago (Rajala et al., 2010; Johal et al., 2015).
medio XF químicamente definido
medio Xeno-libre se ha recomendado como un reemplazo para FBS y suero, ya que contiene los componentes necesarios para la expansión de ASC, no implica donante o variación de lote a lote, es compatible con GMP y tiene inmunogenicidad mínima e inmunosupresión favorable (van der Valk et al., 2004, 2010; Usta et al.,, 2014). En comparación con el FBS, el uso del medio XF para la expansión de ASCs ha llevado a una mejor calidad morfológica, aumento de la proliferación, un inmunofenotipo comparable y diferenciación en adiposo, hueso y cartílago (Lindroos et al., 2009; Patrikoski et al., 2013; Oikonomopoulos et al., 2015). El uso de medios XF en la expansión de ASC da como resultado que los ASC pierdan su capacidad de adherirse al plástico (kyllonen et al., 2013; Patrikoski et al., 2013; Oikonomopoulos et al., 2015). Se necesitan agentes de recubrimiento adicionales para mantener la característica inherente de la adherencia plástica asociada con ASCs., El medio XF disponible comercialmente es costoso y preparar el medio XF interno puede llevar mucho tiempo y puede aumentar el riesgo de variación de lote a lote (Lund et al., 2009; Baer et al., 2010; Rajala et al., 2010; Yang et al., 2012; Kyllonen et al., 2013; Patrikoski et al., 2013; Oikonomopoulos et al., 2015).
Human Alternatives
Human alternatives can replace FBS and SF / XF supplemented media and can create a culture environment that more accurately remembers the human environment (Azouna et al., 2012; Koellensperger et al., 2014)., Además, el uso de productos autólogos (derivados del mismo individuo) elimina la necesidad de realizar pruebas para detectar agentes infecciosos y otros agentes causantes de enfermedades.
suero humano
después de que se ha permitido que la sangre entera se coagule en ausencia de un anticoagulante y se ha centrifugado, el suero es la porción líquida resultante que no contiene plaquetas, glóbulos blancos o glóbulos rojos (Figura 1; Stedman, 2006). El suero humano (HS) puede ser autólogo (donante y receptor son el mismo individuo) o alogénico (derivado de individuos que son diferentes del receptor)., Tanto el HS autólogo como el alogénico son superiores al FBS (Stute et al., 2004; Bieback et al., 2009, 2012; Bernardo et al., 2011; Kyllonen et al., 2013; Patrikoski et al., 2013). Las ASCs expandidas en HS tienen una mayor estabilidad del transcriptoma que las expandidas en FBS, mientras que los genes responsables de la prolongación del ciclo celular, la diferenciación y la matriz extracelular y la síntesis de prostaglandinas se regulan y sobreexpresan en FBS cuando se comparan con HS usando análisis de microarray (Shahdadfar et al., 2005)., Las ASCs expandidas en FBS alcanzaron senescencia más pronto y mostraron acortamiento de telómeros cuando se compararon con las ASCs expandidas en HS (Shahdadfar et al., 2005). La elección del HS parece tener poco efecto sobre las propiedades inmunomoduladoras de las ASCs. Las ASCs expandidas en medios que contienen HS o FBS alogénicos tuvieron baja inmunogenicidad y resultaron en inmunosupresión (Patrikoski et al., 2014). Las ASCs expandidas en HS autóloga o alogénica muestran una mayor proliferación y un inmunofenotipo indistinguible en comparación con las ASCs expandidas en FBS (Josh et al., 2012; Bogdanova et al., 2014)., Las ASCs expandidas en HS alogénicas se han diferenciado en adiposo, hueso y cartílago, aunque se favoreció la regulación ascendente de los genes condrogénicos y osteogénicos en comparación con FBS (Josh et al., 2012). Las ASCs expandidas en HS autólogas se han diferenciado en adiposo y cartílago; sin embargo, la capacidad de diferenciarse en hueso fue menos favorecida (Bogdanova et al., 2014). El HS autólogo puede proporcionar a las ASCs una mejor proliferación y estabilidad genómica determinada por el análisis de microarrays en comparación con el HS alogénico (Shahdadfar et al., 2005; Bieback et al., 2009; Bernardo et al., 2011)., Las ASCs expandidas en HS alogénicas entraron en detención del crecimiento y se sometieron a muerte celular (Shahdadfar et al., 2005; Lindroos et al., 2009), que limita las ventajas potenciales del SA alogénico. Mientras autólogo HS podría ser ideal, su disponibilidad es limitada y puede haber una variación significativa entre los pacientes en la capacidad de su propio suero para apoyar el crecimiento de sus propias células (Lange et al., 2007). Alternativamente, el HS alogénico se puede agrupar, produciendo cantidades más grandes para la experimentación de laboratorio y puede someterse a pruebas rigurosas de calidad por un banco de sangre (p. ej.,, pruebas para la ausencia de agentes infecciosos y contaminación con otras células sanguíneas) antes de su uso en humanos (Bieback et al., 2009).
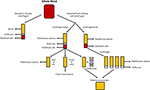
la Figura 1. Producción de las diferentes alternativas humanas. El suero se produce cuando se permite que la sangre entera se coagule y se centrifuga para pellet glóbulos rojos y blancos, y plaquetas. El Plasma se produce mediante la prevención de la coagulación seguida de la centrifugación., Dependiendo de la velocidad de centrifugación, se produce plasma pobre en plaquetas (PPP; centrifugación rápida) o plasma rico en plaquetas (PRP; centrifugación más lenta). Si el PPP se almacena a -18 ° C se conoce como plasma fresco congelado. Los concentrados de plaquetas se pueden producir ya sea tomando el plasma pobre en plaquetas y 4 capas buffy y agrupándolos juntos o centrifugando múltiples PRP y agrupando los gránulos de plaquetas (suspendidos en una pequeña cantidad de plasma) juntos.,
Plasma
el Plasma es la no-celulares porción líquida de la sangre que contiene agua, electrolitos y proteínas (factores de coagulación, fibrinógeno, y anticoagulantes). El plasma pobre en plaquetas (PPP), el plasma fresco congelado (FFP) y el plasma rico en plaquetas (PRP; Figura 1) se pueden obtener de sangre entera por centrifugación a diferentes velocidades, y posterior almacenamiento a diferentes temperaturas. La secreción de GF se puede aumentar activando las plaquetas en la sangre completa con trombina antes de la centrifugación (Doucet et al., 2005; Kocaoemer et al.,, 2007), mejorando así la actividad de los productos de plasma.
plasma pobre en Plaquetas
el PPP está casi libre de plaquetas y se produce a partir de sangre completa mediante la adición de un anticoagulante durante el proceso de recolección, después de lo cual el plasma se separa mediante centrifugación rápida (Figura 1; Koellensperger et al., 2006). Esto permite que las plaquetas y los glóbulos rojos a ser granulada. El PPP resultante se almacena a 4°C y se conoce como plasma fresco., El PDGF es secretado por las plaquetas agregantes; sin embargo, el PDGF insignificante es liberado en PPP como resultado del pequeño número de plaquetas residuales. Por lo tanto, es posible que sea necesario agregar GFs a PPP cuando se usa en medios, como es el caso cuando se usa un medio SF (Müller et al., 2006; Gottipamula et al., 2013). El uso de PPP sin la adición de GFs ha resultado en tasas de proliferación más bajas y un menor aumento en la síntesis de ADN medida mediante la incorporación de timidina, en comparación con HS y FBS (Vogel et al., 1980; Koellensperger et al., 2006)., PPP con GFs añadido resultó en un aumento de las tasas de proliferación en comparación con HS (Koellensperger et al., 2006); sin embargo, estas diferencias podrían haber surgido de diferentes protocolos de producción de PPP y la adición de diferentes niveles de GFs a cada una de las preparaciones de PPP en este estudio. La expansión de ASCs en PPP resulta en una mejor proliferación en comparación con FBS, y tiene diferenciación osteogénica que es comparable a la de ASCs expandida en HS (Koellensperger et al., 2014)., La diferenciación condrogénica disminuyó en las ASCs expandidas en PPP en comparación con las ASCs expandidas en PRP (Koellensperger et al., 2014).
el plasma fresco congelado
FFP se obtiene de la misma manera que PPP, pero se congela directamente después de la separación a -18°C (O’Shaughnessy et al., 2004; Liumbruno et al., 2009). FFP se ha utilizado en la expansión de BM-MSCs con resultados positivos., Estos resultados incluyen una mejor proliferación, actividad inmunosupresora y diferenciación en adipocitos y osteocitos; y un inmunofenotipo y morfología que es comparable a las células expandidas en FBS (Müller et al., 2006; Mannello y Tonti, 2007). Sin embargo, el uso de FFP como sustituto del suero en la expansión de ASC requiere más investigación.
plasma rico en Plaquetas
PRP es la porción de sangre que está enriquecida en plaquetas. El PRP se produce separando el plasma de los glóbulos rojos a velocidades de centrifugación más lentas, lo que impide la granulación de las plaquetas (Figura 1)., Las ASCs expandidas en PRP mantienen un inmunofenotipo y morfología clásicos, y PRP aumenta la proliferación en comparación con FBS (Kocaoemer et al., 2007; Chieregato et al., 2011; Atashi et al., 2015). Las ASCs expandidas en PRP han mejorado la eficiencia de diferenciación hacia linajes adipogénicos y osteogénicos, mientras que tienen una eficiencia comparable para la diferenciación condrogénica, cuando se comparan con las ASCs expandidas en FBS (Kocaoemer et al., 2007; Chieregato et al., 2011). Cuando se comparó, se encontró que el HS era ligeramente mejor que el PRP en términos de diferenciación y proliferación de ASCs (Kocaoemer et al.,, 2007; Chieregato et al., 2011). El PRP es un suplemento de medio de cultivo mal definido debido a su alta variabilidad biológica y complicado procedimiento de extracción, en el que la purificación del sobrenadante rico en factor plaquetario de las membranas plasmáticas puede ser difícil. El uso de PRP está limitado por las grandes cantidades de sangre entera necesarias para producir suficiente PRP para la experimentación (Chieregato et al., 2011).,
Lisado plaquetario
el lisado plaquetario humano (HPL) contiene GFs plaquetarias que se obtienen por Lisado de plaquetas concentradas en un pequeño volumen de plasma (concentrados de plaquetas; Figura 1) por choque térmico. HPL contiene una concentración más alta de GFs que otros sustitutos del suero incluyendo PRP humano y FBS (Doucet et al., 2005; Bernardo et al., 2006, 2011; Bieback et al., 2009; Schallmoser et al., 2010)., El HPL se puede obtener y producir fácilmente a partir de productos de Aféresis y capas buffy, y se puede resuspender en PRP o en una solución aditiva (Schallmoser y Strunk, 2013; Iudicone et al., 2014). El HPL se produce congelando las plaquetas entre -30 y -80°C durante 24 h, seguido de una etapa de descongelación y centrifugación. Los ciclos repetidos de congelación, descongelación y centrifugación permiten la liberación de GFs y la eliminación de cuerpos plaquetarios (Bernardo et al., 2006; Schallmoser et al., 2007)., Otro beneficio de la suplementación con HPL es que las plaquetas se pueden usar después de la fecha de caducidad de 4-5 días de la sangre almacenada(Bieback et al., 2009). El HPL es una mejor alternativa que el HS autólogo y alogénico, ya que las ASCs expandidas en HPL mantienen su inmunofenotipo clásico, diferenciación, eficiencia clonogénica, pureza celular y viabilidad celular (Trojahn Kølle et al., 2013; Riis et al., 2016). HPL también apoya la expansión a largo plazo sin comprometer las propiedades inmunomoduladoras de ASCs, según lo medido por el análisis citométrico de flujo (Bieback et al., 2009)., La expansión en HPL resulta en un tiempo de duplicación de la población más corto, reduciendo el tiempo requerido para la expansión celular y disminuyendo la amenaza de senescencia y transformación (Doucet et al., 2005; Shahdadfar et al., 2005; Bernardo et al., 2006, 2011; Azouna et al., 2012). La bioseguridad de la HPL se ha evaluado mediante hibridación genómica comparativa de matrices y cariotipado espectral de alta sensibilidad, donde se encontró que las ASCs expandidas en la HPL no tenían aberraciones cromosómicas (Crespo-diaz et al., 2011; Trojahn Kølle et al., 2013)., La morfología clásica de los ASC (delgados, más pequeños, alargados y en forma de huso) se mantiene en HS y HPL, mientras que los ASC expandidos en FBS son más grandes y tienen menos forma de huso (Trojahn Kølle et al., 2013). Aunque esto puede indicar que tanto HS como HPL seleccionan ASCs primitivas / inmaduras (Doucet et al., 2005; Bieback et al., 2009), también sugiere que las células cultivadas en FBS han reducido la proliferación y progresan más rápidamente hacia la senescencia. HPL varía entre individuos (Bernardo et al., 2006; Crespo-diaz et al., 2011), y la variación de lote a lote se reduce cuando se agrupa el HPL (Schallmoser et al.,, 2007; Trojahn Kølle et al., 2013). Además, al reunir a muchos donantes, se puede obtener una gran cantidad para la suplementación, lo que hace que la HPL sea preferible a la PRP (Kocaoemer et al., 2007; Bieback et al., 2009; Chieregato et al., 2011).
conclusión
según Riis et al. de todos los ensayos clínicos registrados que utilizan ASCs expandidos que han enumerado sus condiciones de expansión, la mayoría utiliza FBS, tres ensayos utilizan HS autólogo, un ensayo utiliza PRP y un ensayo utiliza HPL (Riis et al., 2015)., Estas estadísticas son alarmantes, ya que el FBS tiene el potencial de transmitir enfermedades zoonóticas después de un trasplante celular, y se han reportado reacciones inmunes contra los componentes del FBS (Selvaggi et al., 1997; Mackensen et al., 2000). El FBS es un producto que no cumple con las GMP, ya que afecta la seguridad y la eficacia de la ASC terapéutica, y por lo tanto necesita ser reemplazado (van der Valk et al., 2004; Kyllonen et al., 2013; Witzeneder et al., 2013). Esto se ha remediado mediante la sustitución de FBS con alternativas derivadas químicamente definidas por humanos., El cambio de FBS a alternativas humanas o medios XF / SF en Medicina Regenerativa tiene la importante ventaja de que las ASCs proliferan mucho más rápido en este último, lo que resulta en un mayor número de células para trasplante en un tiempo más corto. Sin embargo, la superioridad relativa de los diferentes medios culturales sigue siendo ampliamente debatida. Los estudios que comparan más de un medio de cultivo han reportado resultados variables (Lange et al., 2007; Bernardo et al., 2011; Koellensperger et al., 2014; Riis et al., 2016). Koellensperger et al., se comparó la diferenciación trilineal de las ASCs expandidas en FBS, PRP, PPP y HS (Koellensperger et al., 2014). Sus resultados revelaron que cada medio de cultivo permitía la diferenciación en uno o más linajes, pero nunca en los tres linajes. Cuando se compararon medios XF, FBS y medios suplementados HPL, Riis et al. encontraron que ciertas subpoblaciones expresaban marcadores de superficie específicos dependiendo del medio de cultivo utilizado (Riis et al., 2016)., Los estudios que compararon el inmunofenotipo de las ASCs expandidas en FBS y los otros medios de cultivo, encontraron poca o ninguna diferencia en la expresión de marcadores de superficie celular, independientemente de los marcadores estudiados (Tabla 1). La densidad de siembra, la tensión de oxígeno, la confluencia, la disociación y la elección de medios basales también pueden influir en los resultados experimentales (Sotiropoulou et al., 2006; Freshney, 2010; Bourin et al., 2013; Inamdar e Inamdar, 2013; Feng et al., 2014; Riis et al., 2015)., La elección del medio de cultivo depende de la aplicación posterior de estas células (administración de ASCs diferenciadas o no diferenciadas) y de la condición a tratar. Además, la inmunogenicidad del medio de cultivo utilizado para expandir las células antes de la aplicación clínica debe considerarse como un parámetro que podría influir en el resultado clínico. La mayoría de los estudios que compararon diferentes medios de cultivo utilizaron los criterios especificados por el ISCT y el IFATS para validar el uso de una alternativa al FBS., La mayoría de estos estudios examinan la morfología, la proliferación, el inmunofenotipo y la capacidad de estas células para diferenciarse a lo largo de los linajes osteogénicos, condrogénicos y adipogénicos en diferentes medios de cultivo. Pocos estudios han explorado otros aspectos de las ASCs, como la senescencia, la estabilidad genética, el transcriptoma, el proteoma, la inmunogenicidad, la secreción de citoquinas y el ciclo celular (Shahdadfar et al., 2005; Bieback et al., 2012). Mientras que los criterios ISCT e IFATS fueron un intento de unificar el campo en términos de procedimientos operativos estándar (Dominici et al., 2006; Bourin et al.,, 2013), no existe consenso en torno a qué propiedades de las ASCs son relevantes para los ensayos clínicos, por lo que la comparación de diferentes medios de cultivo es prácticamente imposible. Si bien estos criterios proporcionan resultados mensurables para facilitar la comparación, los componentes cambiantes utilizados para la expansión de los ASC pueden tener diferentes efectos sobre la seguridad, la eficacia y la reproducibilidad de los productos finales de ASC. Es importante examinar los cambios en el transcriptoma, el proteoma y el secretoma de las ASCs expandidas en varios medios de cultivo, al igual que el uso de células expandidas en condiciones variables en modelos preclínicos apropiados.,

la Tabla 1. Los efectos de los diferentes suplementos de medios en ASCs in vitro.
Aportes del Autor
CD conceptualizado y redactó la revisión, y aprobado el manuscrito final. MP ayudó en la conceptualización de la revisión, revisó y aprobó el manuscrito final. MSP ayudó en la conceptualización de la revisión, editó y aprobó el manuscrito final, y recaudó fondos para los proyectos en cuestión. Todos los autores han leído y aprobado el manuscrito final.,
financiación
Esta investigación y la publicación de la misma es el resultado de la financiación proporcionada por el Consejo de Investigación Médica de Sudáfrica en términos de (A) El Proyecto de premios Flagships del MRC SAMRC-RFA-UFSP-01-2013/células madre, así como (b) La unidad Extramural para la investigación y Terapia de Células Madre. La Fundación Nacional de Investigación de Sudáfrica también proporcionó financiación.
Declaración de conflicto de intereses
los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran ser interpretadas como un potencial conflicto de intereses.,
agradecimientos
Los autores agradecen a la Dra. Cheryl Tosh su ayuda editorial.
Chieregato, K., Castegnaro, S., Madeo, D., Astori, G., Pegoraro, M., and Rodeghiero, F. (2011). El factor de crecimiento epidérmico, el factor de crecimiento básico de fibroblastos y el factor de crecimiento derivado de plaquetas-bb pueden sustituir al suero bovino fetal y competir con el plasma rico en plaquetas humanas en la expansión ex vivo de las células estromales mesenquimales derivadas del tejido adiposo. Cytotherapy 13, 933-943. doi: 10.3109 / 14653249.2011.,583232
PubMed Abstract | CrossRef Full Text/Google Scholar
Mannello, F., and Tonti, G. (2007). Revisión concisa: no hay avances para el cultivo de células madre mesenquimales y embrionarias humanas: medio condicionado, capa alimentadora o sin alimentador; medio con suero fetal de ternera, suero humano o plasma enriquecido; medio sin suero, sin reemplazo de suero No acondicionado o fórmula ad hoc? ¡todo lo que brilla no es oro! Stem Cells 25, 1603-1609. doi: 10.1634 / células madre.2007-0127
PubMed Abstract | CrossRef Full Text/Google Scholar
Selvaggi, T. A., Walker, R. E.,, and Fleisher, T. A. (1997). Desarrollo de anticuerpos frente al suero fetal de ternera con reacciones de tipo arthus en pacientes infectados por el virus de la inmunodeficiencia humana a los que se administraron infusiones de linfocitos singenéticos. Sangre 89, 776-779.
PubMed Abstract/Google Scholar
Stedman, T. L. (2006). Stedman s Medical Dictionary. Philadelphia, PA: Lippincott Williams & Wilkins.
Google Scholar