¿cómo funciona un búfer?
un tampón es capaz de resistir el cambio de pH porque los dos componentes (ácido conjugado y base conjugada) están presentes en cantidades apreciables en equilibrio y son capaces de neutralizar pequeñas cantidades de otros ácidos y bases (en forma de H3O+ y OH -) cuando se agregan a la solución. Para aclarar este efecto, podemos considerar el ejemplo simple de un tampón de ácido fluorhídrico (HF) y fluoruro de sodio (NaF)., El ácido fluorhídrico es un ácido débil debido a la fuerte atracción entre el relativamente pequeño F – ion y los protones solvatados (H3O+), que no le permite disociarse completamente en agua. Por lo tanto, si obtenemos HF en una solución acuosa, establecemos el siguiente equilibrio con solo una ligera disociación (Ka(HF) = 6.6×10-4, favorece fuertemente a los reactivos):
\
luego podemos agregar y disolver fluoruro de sodio en la solución y mezclar los dos hasta alcanzar el volumen deseado y el pH al que queremos amortiguar., Cuando el fluoruro de sodio se disuelve en agua, la reacción se completa, así obtenemos:
\
dado que Na+ es el conjugado de una base fuerte, no tendrá ningún efecto sobre el pH o la reactividad del tampón. La adición de \(NaF\) a la solución, sin embargo, aumentará la concentración de F – en la solución tampón, y, en consecuencia, por el principio de Le Chatelier, conducir a un poco menos de disociación de la HF en el equilibrio anterior, también. La presencia de cantidades significativas tanto del ácido conjugado, \(HF\), como de la base conjugada, F -, permite que la solución funcione como tampón., Esta acción de amortiguación se puede observar en la curva de valoración de una solución tampón.
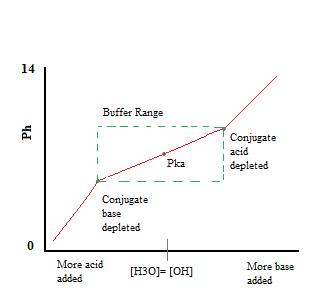
Como podemos ver, sobre el rango de trabajo de la memoria intermedia. el pH cambia muy poco con la adición de ácido o base. Una vez que se supera la capacidad de almacenamiento en búfer, la tasa de cambio de pH salta rápidamente. Esto ocurre porque el ácido conjugado o la base se ha agotado a través de la neutralización. Este principio implica que una mayor cantidad de ácido conjugado o base tendrá una mayor capacidad de amortiguación.,
Si se añade ácido:
\
en esta reacción, la base conjugada, F-, neutralizará el ácido añadido, H3O+, y esta reacción se completa, porque la reacción de F – con H3O+ tiene una constante de equilibrio mucho mayor que uno. (De hecho, la constante de equilibrio la reacción tal como está escrita es solo la inversa del Ka para HF: 1/Ka(HF) = 1/(6.6×10-4) = 1.5×10+3., Mientras haya más F-que H3O+, casi todo el H3O+ se consumirá y el equilibrio se desplazará hacia la derecha, aumentando ligeramente la concentración de HF y disminuyendo ligeramente la concentración de F-, pero dando como resultado casi ningún cambio en la cantidad de H3O+ presente una vez que se restablezca el equilibrio.,
Si se añade la base:
\
en esta reacción, el ácido conjugado, HF, neutralizará las cantidades añadidas de base, OH-, y el equilibrio volverá a cambiar a la derecha, aumentando ligeramente la concentración de F – en la solución y disminuyendo ligeramente la cantidad de HF. Una vez más, ya que la mayor parte del OH – se neutraliza, poco cambio de pH se producirá.
estas dos reacciones pueden continuar alternándose hacia adelante y hacia atrás con poco cambio de pH.