Rutherford en Manchester, 1907-1919
Ernest Rutherford descubrió el núcleo del átomo en 1911. Leemos esto en libros de texto y en escritos populares. Pero, ¿qué significa esa declaración? El descubrimiento geográfico generalmente significa que uno ve un lugar por primera vez. ¿Pero el descubrimiento puede ser lo mismo para un reino oculto a la vista? Uno no puede ver un átomo en ese sentido., Así que esto sugiere que tal vez la historia del descubrimiento del núcleo era más complicada. La historia que se desarrolló en el laboratorio de Rutherford en la Universidad de Manchester giró en torno a personas reales. Implicaba frustraciones y triunfos. Implicó trabajo duro, perplejidad e inspiración.
 cuando Rutherford se convirtió en profesor en Manchester en 1907, encontró laboratorios modernos para la enseñanza y la investigación. A instancias de su predecesor, Arthur Schuster, se recaudaron más de £40,000 para dotar al programa de física. En comparación, el generoso salario de Rutherford fue de £1,600 / año., Crédito: del libro: The physical laboratories of the University of Manchester: a record of 25 years’ work by the University of Manchester, Manchester: At the University Press, 1906. AIP Emilio Segrè archivo Visual, colección de libros quebradizos.Rutherford llegó a Manchester en el verano de 1907, meses antes de que comenzara el período de la Universidad. Fue nombrado profesor Langworthy de Física, sucesor de Arthur Schuster (1851-1934), quien se retiró a los 56 años para reclutar a Rutherford. Schuster había construido un edificio de física moderna, contrató a Hans Geiger, Ph. D., (1882-1945) debido a su habilidad experimental, y dotado de una nueva posición en la física matemática para completar un programa completo de física. Rutherford entró en el centro del mundo de la física. Los investigadores acudieron a él por docenas.
cuando Rutherford se convirtió en profesor en Manchester en 1907, encontró laboratorios modernos para la enseñanza y la investigación. A instancias de su predecesor, Arthur Schuster, se recaudaron más de £40,000 para dotar al programa de física. En comparación, el generoso salario de Rutherford fue de £1,600 / año., Crédito: del libro: The physical laboratories of the University of Manchester: a record of 25 years’ work by the University of Manchester, Manchester: At the University Press, 1906. AIP Emilio Segrè archivo Visual, colección de libros quebradizos.Rutherford llegó a Manchester en el verano de 1907, meses antes de que comenzara el período de la Universidad. Fue nombrado profesor Langworthy de Física, sucesor de Arthur Schuster (1851-1934), quien se retiró a los 56 años para reclutar a Rutherford. Schuster había construido un edificio de física moderna, contrató a Hans Geiger, Ph. D., (1882-1945) debido a su habilidad experimental, y dotado de una nueva posición en la física matemática para completar un programa completo de física. Rutherford entró en el centro del mundo de la física. Los investigadores acudieron a él por docenas.
Rutherford llegó con muchas preguntas de investigación en mente. No había terminado con los rompecabezas de las familias de decaimiento de torio, radio, etc. pero estaba pasando gran parte de este trabajo a Boltwood, Hahn y Soddy. Boltwood y Hahn trabajaron con Rutherford en Mánchester, Boltwood en 1909-1910 y Hahn en 1907-1908., Rutherford gradualmente estaba volviendo su atención mucho más a los rayos α (Alfa), β (beta) y γ (gamma) y a lo que podrían revelar sobre el átomo. Es decir, estaba dejando la radioquímica a otros y volviendo a la física.
 Rutherford siempre reunió a un grupo de jóvenes investigadores brillantes a su alrededor. En esta foto de grupo de 1910 están Ernest Marsden y Hans Geiger. Al frente y al centro están los profesores Schuster y Rutherford, y en la parte trasera está William Kay, el talentoso y servicial administrador del laboratorio. Crédito: J. B. Birks, ed.,, Rutherford at Manchester (London: Heywood & Co., 1962), frente a p. 38. el primer equipo de Rutherford en Manchester incluyó a Geiger y William Kay (1879-1961), asistente de laboratorio junior desde 1894. Rutherford promovió a Kay a mayordomo de laboratorio en 1908, para administrar el equipo de laboratorio y ayudarlo en su investigación. En 1957, Kay recordó su juventud con Rutherford en una entrevista. El lenguaje es pintoresco, pero la descripción es lo más cercano al enfoque de Rutherford que tenemos., El interrogador fue Samuel Devons (1914-2006), que fue uno de los últimos estudiantes de Rutherford en la década de 1930.
Rutherford siempre reunió a un grupo de jóvenes investigadores brillantes a su alrededor. En esta foto de grupo de 1910 están Ernest Marsden y Hans Geiger. Al frente y al centro están los profesores Schuster y Rutherford, y en la parte trasera está William Kay, el talentoso y servicial administrador del laboratorio. Crédito: J. B. Birks, ed.,, Rutherford at Manchester (London: Heywood & Co., 1962), frente a p. 38. el primer equipo de Rutherford en Manchester incluyó a Geiger y William Kay (1879-1961), asistente de laboratorio junior desde 1894. Rutherford promovió a Kay a mayordomo de laboratorio en 1908, para administrar el equipo de laboratorio y ayudarlo en su investigación. En 1957, Kay recordó su juventud con Rutherford en una entrevista. El lenguaje es pintoresco, pero la descripción es lo más cercano al enfoque de Rutherford que tenemos., El interrogador fue Samuel Devons (1914-2006), que fue uno de los últimos estudiantes de Rutherford en la década de 1930.
 Hans Geiger fue el Socio principal de Rutherford en la investigación de rayos alfa de 1907 a 1913. Juntos desarrollaron varias formas de detectar los rayos alfa. Demostraron que los rayos alfa son núcleos de helio doblemente ionizados. Ca. 1908. Crédito: AIP Emilio Segre Visual Archives, Physics Today Collection.Rutherford y Hans Geiger trabajaron estrechamente en 1907 y 1908 en la detección y medición de partículas α., Si iban a utilizar partículas α para sondear el átomo, primero tenían que saber más sobre estas partículas y su comportamiento. Rutherford había intentado y fallado en McGill para contar partículas α.
Hans Geiger fue el Socio principal de Rutherford en la investigación de rayos alfa de 1907 a 1913. Juntos desarrollaron varias formas de detectar los rayos alfa. Demostraron que los rayos alfa son núcleos de helio doblemente ionizados. Ca. 1908. Crédito: AIP Emilio Segre Visual Archives, Physics Today Collection.Rutherford y Hans Geiger trabajaron estrechamente en 1907 y 1908 en la detección y medición de partículas α., Si iban a utilizar partículas α para sondear el átomo, primero tenían que saber más sobre estas partículas y su comportamiento. Rutherford había intentado y fallado en McGill para contar partículas α.
un año más tarde en Manchester, él y Geiger tuvieron éxito con dos métodos de observación de partículas α. El primer método involucró centelleos excitados por partículas α en una capa delgada de sulfuro de zinc. Los observaron a través de un microscopio y contaron los centelleos en diferentes ángulos de dispersión., También desarrollaron un «electrómetro» que podía demostrar el paso de una partícula α individual a una gran audiencia. El instrumento, que evolucionó en el «contador Geiger», tenía un cilindro de metal parcialmente Evacuado con un cable en su centro. Aplicaron un voltaje entre el cilindro y el cable lo suficientemente alto como para chispear. Admitieron partículas α a través de una delgada ventana de mica, donde estas partículas colisionaron con gases, produciendo iones de gas. Estos luego chocaron con otras moléculas y produjeron más iones, y así sucesivamente., Cada partícula α produce una cascada de iones, que descargan parcialmente el cilindro e indican el paso de una partícula α. Geiger y Rutherford publicaron varios artículos en 1908 y 1909 sobre estos métodos y su uso.Rutherford escribió a Henry Bumstead (1870-1920), un físico estadounidense, el 11 de julio de 1908:
Geiger es un buen hombre y trabajó como un esclavo. Nunca podría haber encontrado tiempo para el trabajo pesado antes de que las cosas salieran bien. Finalmente todo salió bien, pero la dispersión es el diablo. Nuestro tubo funcionó como un encanto y pudimos obtener fácilmente un tiro de 50 mm., para cada partícula. … Geiger es un demonio en el trabajo de contar centelleos y podría contar a intervalos durante toda una noche sin perturbar su ecuanimidad. Condené vigorosamente y me retiré después de dos minutos. (Citado en Eve, p. 180.)
aunque Rutherford sospechó ya en 1906 que las partículas α eran átomos de helio despojados de sus electrones, exigió un alto nivel de prueba. Un tipo de experimento no era suficiente. Un tipo de detector no era suficiente. Quería más pruebas., Para esto, Rutherford deseaba «grandes voltajes» y grandes electroimanes para desviar partículas α, pero este método aún no estaba maduro. El administrador de laboratorio William Kay recordó en la citada entrevista de historia oral que Rutherford en 1908 insistió en que se necesitaban fuertes campos eléctricos y magnéticos para medir más directamente la carga y la masa de las partículas α y β:
Kay dijo que Rutherford quería un imán grande refrigerado por agua, pero que «lo dejó caer como un pastel caliente» cuando se enteró de su costo. Así que necesitaba una nueva línea de ataque. La nueva línea era muy simple, un procedimiento químico mezclado con la física., Para este trabajo Rutherford reclutó a Thomas Royds (1884-1955), que había obtenido su título de Física con honores en 1906. Recogieron partículas α en un tubo de vidrio sellado, las comprimieron y pasaron una chispa eléctrica. Estudiaron la luz emitida en un espectroscopio y encontraron que era idéntica al espectro del helio. En pocos meses, Rutherford fue galardonado con el Premio Nobel de Química, » por sus investigaciones sobre la desintegración de los elementos, y la química de las sustancias radiactivas., Rutherford y Royds habían establecido la identidad y las propiedades primarias de las partículas α. Rutherford volvió su atención a usarlas para sondear el átomo.
El otoño de 1908 comenzó una importante serie de investigaciones. Geiger había estado pasando haces de partículas α a través de oro y otras láminas metálicas, utilizando las nuevas técnicas de detección para medir cuánto estos haces fueron dispersados por los átomos en las láminas. Geiger pensó Ernest Marsden (1889-1970), un estudiante de 19 años de edad en la física de Honores, estaba listo para ayudar en estos experimentos y se lo sugirió a Rutherford., Dado que Rutherford a menudo empujó a los estudiantes de tercer año a la investigación, diciendo que esta era la mejor manera de aprender sobre la física, estuvo de acuerdo.
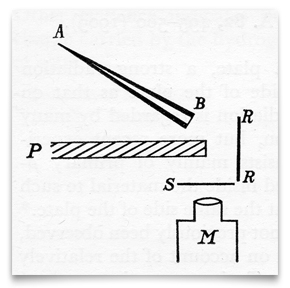 este boceto, del artículo de Geiger y Marsden de 1909, muestra un tubo de vidrio cónico lleno de» emanación de radio » (radón), cerrado en B con un delgado panel de mica. Esta fue su fuente de partículas alfa (α). S era una pantalla de sulfuro de zinc, que centelleaba cuando era golpeada por una partícula α. P era una pantalla de plomo, que bloqueaba cualquier partícula α de viajar directamente a la pantalla de sulfuro de zinc., RR era una lámina (o láminas) de diferentes metales (incluido el oro) que «reflejaban difusamente» partículas α incidentes. Geiger and Marsden observed the resulting scintillations through an observing microscope, M. Credit: H. Geiger and E. Marsden, «On a Diffuse Reflection of the α-Particles,» Proceedings of the Royal Society,1909, 82:495-500.
este boceto, del artículo de Geiger y Marsden de 1909, muestra un tubo de vidrio cónico lleno de» emanación de radio » (radón), cerrado en B con un delgado panel de mica. Esta fue su fuente de partículas alfa (α). S era una pantalla de sulfuro de zinc, que centelleaba cuando era golpeada por una partícula α. P era una pantalla de plomo, que bloqueaba cualquier partícula α de viajar directamente a la pantalla de sulfuro de zinc., RR era una lámina (o láminas) de diferentes metales (incluido el oro) que «reflejaban difusamente» partículas α incidentes. Geiger and Marsden observed the resulting scintillations through an observing microscope, M. Credit: H. Geiger and E. Marsden, «On a Diffuse Reflection of the α-Particles,» Proceedings of the Royal Society,1909, 82:495-500.
Geiger y Marsden comenzaron con la dispersión de ángulo pequeño y probaron varios espesores de láminas, buscando relaciones matemáticas entre la dispersión y el grosor de la lámina o el número de átomos atravesados., Marsden más tarde recordó que Rutherford le dijo en medio de estos experimentos: «mira si puedes obtener algún efecto de las partículas alfa reflejadas directamente de una superficie metálica.»(Reportado por Marsden en Birks, 1962, p. 8). Marsden dudaba de que Rutherford esperara una dispersión posterior de partículas α, pero como Marsden escribió
was fue una de esas «corazonadas» que tal vez se pudiera observar algún efecto, y que en cualquier caso ese territorio vecino de esta tierra de Tom Tiddler podría ser explorado por reconocimiento., Rutherford siempre estaba listo para enfrentar lo inesperado y explotarlo, cuando era favorable, pero también sabía cuándo detenerse en tales excursiones. (Birks, 1962, p. 8)
Este fue el enfoque lúdico de Rutherford en acción. Sus estudiantes y otros probaron sus ideas, muchas de las cuales eran callejones sin salida. Esta idea de buscar retrodispersión de partículas α, Sin embargo, dio sus frutos., Rutherford escribió:
El experimento, dirigido por la imaginación disciplinada de un individuo o, mejor aún, de un grupo de individuos de perspectiva mental variada, es capaz de lograr resultados que trascienden con mucho la imaginación sola del filósofo más grande. (Citado en Eve, 1939, Frontmatter)
en algún momento más tarde, en 1908 o 1909, Marsden dijo, informó de sus resultados a Rutherford. Rutherford recordó esto un poco diferente:
recuerdo …más tarde Geiger vino a mí con gran emoción y me dijo: ‘Hemos sido capaces de obtener algunas de las partículas α que vienen hacia atrás…,»Fue el evento más increíble que me ha pasado en mi vida. Era casi increíble como si te despidieran de 15 pulgadas shell en un pedazo de papel de seda y se volvió y golpeó. (Rutherford, 1938, p. 68)
la memoria humana es falible. Ya sea que Marsden o Geiger le dijeran a Rutherford, el efecto fue el mismo. Rutherford dijo que debían preparar una publicación de esta investigación, que presentaron en mayo de 1909. Por otra parte, esto comenzó Rutherford pensando hacia lo que en última instancia, casi dos años más tarde, publicó como una teoría del átomo.,
¿qué estuvo haciendo Rutherford el resto de 1909 y todo 1910? Por un lado, su amigo cercano Boltwood estaba en Manchester para el año académico trabajando con Rutherford en los productos de desintegración radiactiva del radio. También estaba revisando y hablando sobre ideas anteriores sobre la estructura atómica. Lo más importante, estaba tomando el fenómeno de la dispersión de partículas α aparte sistemáticamente y probando cada pieza. Rutherford no tuvo su idea audaz — el átomo nuclear — al instante, pero llegó a ella gradualmente al considerar el problema desde muchos lados.,
en el otoño de 1910 llevó a Marsden de vuelta a Manchester para completar rigurosas pruebas experimentales de sus ideas con Geiger. Restablecieron las tasas de emisión y los rangos de partículas α por fuentes radiactivas y reexaminaron sus análisis estadísticos. Rutherford intentó reconciliar los resultados de dispersión con diferentes modelos atómicos, especialmente el de J. J. Thomson, en el que la electricidad positiva se consideraba dispersa uniformemente en toda la esfera del átomo.
 a page of Rutherford’s early, undated (1910 or 1911), rough notes., Las primeras líneas dicen: «teoría de la estructura del átomo. Supongamos que el átomo consiste en + carga ne en el centro & de carga como electrón distribuido por toda la esfera de radio r. » luego esbozó ideas sobre el cálculo de la fuerza de desviación en una partícula cargada que pasa cerca de este centro cargado. Crédito: J. B. Birks, ed., Rutherford at Manchester (London: Heywood & Co., 1962), pág. 70.
a page of Rutherford’s early, undated (1910 or 1911), rough notes., Las primeras líneas dicen: «teoría de la estructura del átomo. Supongamos que el átomo consiste en + carga ne en el centro & de carga como electrón distribuido por toda la esfera de radio r. » luego esbozó ideas sobre el cálculo de la fuerza de desviación en una partícula cargada que pasa cerca de este centro cargado. Crédito: J. B. Birks, ed., Rutherford at Manchester (London: Heywood & Co., 1962), pág. 70.
en algún momento del invierno de 1910-1911, Rutherford elaboró la idea básica de un átomo con un «centro cargado».,»Como Geiger y Marsden señalaron en su artículo de 1909:
si se tiene en cuenta la alta velocidad y masa de la partícula α, parece sorprendente que algunas de las partículas α, Como muestra el experimento, se puedan girar dentro de una capa de 6 x 10-5 cm. de oro a través de un ángulo de 90°, y aún más. Para producir un efecto similar por un campo magnético, se requeriría el enorme campo de 109 unidades absolutas. (Birks, P., 179)
Rutherford concluyó en su Documento de mayo de 1911 que una desviación tan notable en el camino de una partícula cargada masiva solo podría lograrse si la mayor parte de la masa de, digamos, un átomo de oro y la mayor parte de su carga se concentraran en un cuerpo central Muy pequeño. Nota: en este punto en 1911, Rutherford no llamó a esto un «núcleo».»
necesitas Flash Player instalado para escuchar este clip de audio.,
el primer anuncio público de la teoría nuclear por Rutherford se hizo en una reunión de la Sociedad Literaria y filosófica de Manchester, y nos invitó a los jóvenes a ir a la reunión. Dijo que tenía cosas interesantes que decir y pensó que nos gustaría escucharlas. No sabíamos de qué se trataba en ese momento. Las personas mayores en el laboratorio lo hicieron, por supuesto que Geiger y Marsden lo sabían porque ya estaban haciendo los experimentos. De hecho, a menos que hubieran hecho algo que fuera suficiente para ser decisivo, Rutherford nunca lo mencionó públicamente., Y, por supuesto, Darwin lo sabía mucho antes. Pero eso debe haber sido a principios de 1911, y fuimos a la reunión y nos lo dijo. Y mencionó entonces que había alguna evidencia experimental que había sido obtenida por Geiger y Marsden. Por lo que recuerdo, no dijo más sobre los resultados que que fueron bastante decisivos. Y, como dije antes, nunca habría hecho un anuncio público de ese tipo si no hubiera tenido buenas pruebas., Y esa es una de las características que recorre todo el trabajo de Rutherford, particularmente todo su trabajo hasta el final del período de Manchester. Si nos fijamos en algunos de sus trabajos en los primeros días-yo llamo a McGill los primeros días – estaba bastante convencido de que las partículas alfa eran átomos de helio, pero nunca dijo eso en esas palabras. Siempre dijo que eran átomos de helio o moléculas de hidrógeno o tal vez pudo haber dicho algo más de ese peso., Era muy característico de él que nunca diría que una cosa era así a menos que tuviera evidencia experimental para ello que realmente lo satisfizo.
de hecho, Rutherford fue extremadamente cauteloso al sacar conclusiones sobre esta carga central: «un cálculo simple muestra que el átomo debe ser el asiento de un campo eléctrico intenso para producir una deflexión tan grande en un solo encuentro.»(Birks, p. 183). Trabajó rápidamente y aproximadamente que varias relaciones cuantitativas deberían ser ciertas si esta teoría básica era correcta., En primer lugar, el número de partículas α dispersas a través de un ángulo dado debe ser proporcional al grosor de la lámina. Segundo, ese número debe ser proporcional al cuadrado de la carga nuclear. Por último, debe ser inversamente proporcional a la cuarta potencia de la velocidad de la partícula α. Estas tres ideas establecieron el programa experimental de Geiger y Marsden para el próximo año.
necesitas Flash Player instalado para escuchar este clip de audio.,
El interés de Rutherford estaba entonces casi en su totalidad en la investigación. Había enseñado muy poco en McGill. Era profesor de investigación. Supongo que dio algunas conferencias, pero habrían sido muy pocas. Y su interés estaba naturalmente en el lado de la investigación. Dio algunas conferencias, pero clases elementales, el tipo de cosas que uno esperaría que un hombre supiera antes de venir a la Universidad. Eran las conferencias a los ingenieros. Eran un grupo ruidoso y Rutherford podía mantenerlos bajo control., Tal vez solo había otro hombre en el departamento que podría haberlo hecho, y él (Rutherford?) disfrutó de ellos porque fue capaz de mostrarles los experimentos muy interesantes que uno puede realizar en los cursos de primaria.
a menudo se me ha dicho que Rutherford era un mal profesor. Nunca había oído tal tontería. Es muy cierto que en ocasiones sería un poco aburrido, un poco confundido, pero eso fue solo en muy raras ocasiones. Hubo otras ocasiones en las que fue realmente muy estimulante. Había un tremendo entusiasmo por él.,
Rutherford entretuvo la posibilidad de que el centro cargado sea negativo. Eso suena raro hoy, así que ¿qué lo hizo razonable? Primero, no era muy diferente del modelo de Thomson. En segundo lugar, ya que Rutherford sabía que las partículas α llevan una carga doble+, pensó que esto podría actuar de la misma manera que el sol lo hace en un cometa que se desplaza cerca de él. Lanzaría la partícula α alrededor y de regreso hacia su fuente. También consideró un modelo casi olvidado sugerido por el físico Japonés Hantaro Nagaoka (1865-1950) — el modelo Saturniano., Nagaoka y Rutherford estuvieron en contacto en 1910 y 1911 y Rutherford mencionó el modelo de Nagaoka de «una masa central atrayente rodeada por anillos de electrones rotativos» (Birks, p. 203). El resultado final en este documento crítico de Rutherford, sin embargo, fue el anuncio de Rutherford de que si el átomo era un disco o una esfera, y de hecho si la carga central era positiva o negativa, no afectaría los cálculos. Rutherford siempre tuvo cuidado de no reclamar más de lo que sus resultados podían soportar.,
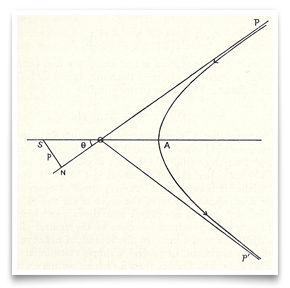 en el ahora famoso artículo de Rutherford de mayo de 1911 sobre la dispersión de partículas alfa por lámina de oro, incluyó este bosquejo de la ruta hiperbólica de una partícula. Crédito: E. Rutherford, » the Scattering of α and β Particles by Matter and the Structure of Matter,» Philosophical Magazine, 1911, 21:669-688.
en el ahora famoso artículo de Rutherford de mayo de 1911 sobre la dispersión de partículas alfa por lámina de oro, incluyó este bosquejo de la ruta hiperbólica de una partícula. Crédito: E. Rutherford, » the Scattering of α and β Particles by Matter and the Structure of Matter,» Philosophical Magazine, 1911, 21:669-688.
Rutherford vio posibles pruebas de la naturaleza de la carga central. La absorción de partículas β, dijo, debe ser diferente con un centro negativo frente a uno positivo., Un centro positivo explicaría la gran velocidad que las partículas α alcanzan durante la emisión de elementos radiactivos. Pero estos eran solo indicios.
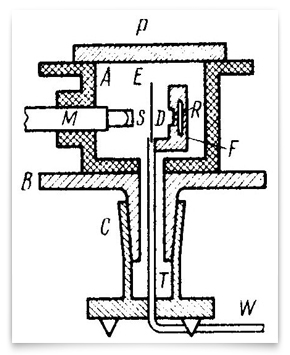 este esquema representa los experimentos refinados de 1912-13 realizados por Geiger y Marsden. R era la fuente de partículas alfa, E era la lámina de oro, y M era el microscopio giratorio alrededor de un eje vertical centrado en la lámina de oro. Las partículas alfa de la fuente pasaron a través del diafragma D, fueron dispersadas por la lámina y se observaron como centelleos en la pantalla S., Geiger y Marsden observaron los ángulos de las partículas dispersas girando el conjunto microscopio-pantalla. Crédito: H. Geiger y E. Marsden, » the Laws of Deflexion Of α Particles through Large Angles,» Philosophical Magazine, 1913, 25:604-623.
este esquema representa los experimentos refinados de 1912-13 realizados por Geiger y Marsden. R era la fuente de partículas alfa, E era la lámina de oro, y M era el microscopio giratorio alrededor de un eje vertical centrado en la lámina de oro. Las partículas alfa de la fuente pasaron a través del diafragma D, fueron dispersadas por la lámina y se observaron como centelleos en la pantalla S., Geiger y Marsden observaron los ángulos de las partículas dispersas girando el conjunto microscopio-pantalla. Crédito: H. Geiger y E. Marsden, » the Laws of Deflexion Of α Particles through Large Angles,» Philosophical Magazine, 1913, 25:604-623.
Geiger y Marsden trabajaron sistemáticamente a través de las implicaciones comprobables de la hipótesis de la carga central de Rutherford. La primera publicación importante de sus resultados fue en alemán en las actas de la Academia de Ciencias de Viena (Sitzungberichte der Wiener Akademie der Wissenschaften) en 1912., Esta versión de 30 páginas fue seguida por una en inglés en 1913 en la revista Philosophical: «the Laws of Deflexion Of α Particles through Large Angles» la versión en inglés es la más conocida. Ligeras diferencias entre los dos llevaron a un historiador a sugerir que Rutherford decidió a favor de un centro cargado positivamente en agosto de 1912 (Trenn, 1974). Los otros miembros del equipo de Rutherford, especialmente Charles Galton Darwin (1887-1962), H. G. J. Moseley (1887-1915), y Niels Bohr (1885-1962) figuraron prominentemente en el establecimiento final del átomo nuclear de Rutherford.,
 el joven Henry G. J. Moseley, en el Balliol-Trinity Laboratory, Oxford, ca. 1910. Más tarde ese año, Moseley comenzó a investigar en el laboratorio de Rutherford en Manchester. Su brillante carrera se vio truncada en combate en la Primera Guerra Mundial. crédito: Universidad de Oxford, Museo de Historia de la ciencia, cortesía de AIP Emilio Segrè Visual Archives, Physics Today Collection.
el joven Henry G. J. Moseley, en el Balliol-Trinity Laboratory, Oxford, ca. 1910. Más tarde ese año, Moseley comenzó a investigar en el laboratorio de Rutherford en Manchester. Su brillante carrera se vio truncada en combate en la Primera Guerra Mundial. crédito: Universidad de Oxford, Museo de Historia de la ciencia, cortesía de AIP Emilio Segrè Visual Archives, Physics Today Collection.
la ‘gran guerra’ interrumpió totalmente el trabajo en el Departamento de Rutherford en Manchester. Bohr regresó a Dinamarca. Marsden aceptó una cátedra en Nueva Zelanda. Moseley murió en la Batalla de Gallipoli., James Chadwick (1891-1974), que estaba trabajando con Geiger en la Universidad Técnica de Berlín cuando estalló la guerra, pasó varios años internado en el campo de Ruhleben para prisioneros de guerra. Otros estudiantes también se fueron a la guerra, y Rutherford dedicó considerable energía a movilizar la ciencia para el esfuerzo de guerra y específicamente a las técnicas antisubmarinas.
 Niels Bohr trabajó por primera vez con Rutherford en Manchester en 1912. Esta foto muestra a los jóvenes Niels y Margrethe Bohr, ca., 1914, cuando Bohr sucedió a Charles Galton Darwin como el lector Schuster en Física Matemática en Manchester. Crédito: AIP Emilio Segre archivo Visual, colección Margrethe Bohr.
Niels Bohr trabajó por primera vez con Rutherford en Manchester en 1912. Esta foto muestra a los jóvenes Niels y Margrethe Bohr, ca., 1914, cuando Bohr sucedió a Charles Galton Darwin como el lector Schuster en Física Matemática en Manchester. Crédito: AIP Emilio Segre archivo Visual, colección Margrethe Bohr.
en este contexto distraído, Rutherford y su mayordomo de laboratorio, William Kay, comenzaron en 1917 a explorar el paso de partículas α a través del hidrógeno, nitrógeno y otros gases. Cuando terminó la Gran Guerra, Ernest Marsden ayudó brevemente con las tediosas observaciones de centelleo que proporcionaron pistas sobre la naturaleza del núcleo. Rutherford reportó los resultados tentativos de estos extensos experimentos en 1919., Rutherford colocó una fuente de radio c (bismuto-214) en un recipiente de latón sellable, ajustado para que la posición de la fuente pudiera cambiarse y para que se pudieran introducir diferentes gases o producir un vacío, según se desee. Las partículas α atravesaron el interior del contenedor y pasaron a través de una hendidura, cubierta por una placa de plata u otro material, y golpearon una pantalla de sulfuro de zinc, donde se observó un centelleo en una habitación oscura. Cuando se introdujo gas hidrógeno en el recipiente y se tuvo cuidado de absorber las partículas α antes de que llegaran a la pantalla, aún se observaron centelleos., Rutherford postuló que a medida que las partículas α atravesaban el gas hidrógeno, ocasionalmente colisionaban con núcleos de hidrógeno. Como escribió Rutherford, esto produjo «átomos rápidos de hidrógeno» que se proyectaron principalmente hacia adelante en la dirección del movimiento original de las partículas α.
Rutherford tenía varias preguntas sutiles en mente durante estos experimentos, principalmente relacionadas con la naturaleza del núcleo., Le pidió a su colega Darwin que analizara estas colisiones basándose en una «teoría simple» de colisiones elásticas entre núcleos puntuales repelidos de acuerdo con una ley del cuadrado inverso, las partículas α llevando una carga de 2 veces la de un electrón (y de signo opuesto) y los núcleos de hidrógeno 1 veces. Darwin encontró que todas las partículas α que se aproximan dentro de 2. 4×10-13 cm producirían un ‘ átomo de hidrógeno rápido.’Esta simple teoría, sin embargo, predijo muchos menos átomos de hidrógeno acelerados que los observados en los experimentos.,
Rutherford rechazó las explicaciones de esta varianza basadas en diferentes cargas en las partículas u otras leyes que las leyes del cuadrado inverso. Más bien, concluyó que para distancias en el orden del diámetro del electrón, » la estructura del núcleo de helio ya no puede considerarse como un punto.». Él postuló que el núcleo de helio (partícula α) tiene una estructura compleja de cuatro núcleos de hidrógeno más dos electrones cargados negativamente. (Diríamos que está compuesto por dos protones., Rutherford concluyó que la deformación de núcleos complejos durante colisiones era una explicación más probable, la variación de las fuerzas entre los núcleos variando de una manera compleja en un acercamiento cercano.
teniendo en cuenta las intensas fuerzas puestas en juego en tales colisiones, no sería sorprendente que el núcleo de helio se rompiera. No se ha observado evidencia de tal desintegración indicating indicando que el núcleo de helio debe ser una estructura muy estable.,
debemos recordar que Rutherford no pudo observar directamente la estructura del núcleo, por lo que sus conclusiones fueron provisionales. Sin embargo, estaba considerando abiertamente las posibilidades de un núcleo complejo, capaz de deformación e incluso de posible desintegración. Estos pensamientos dieron forma a este intenso período de investigaciones experimentales.