4.2. Edema vasogénico
Las alteraciones en el compartimiento vascular se encuentran entre las causas más comunes de edema intersticial (edema vasogénico) y son el resultado de la hipertensión capilar o hipoproteinemia. La presión capilar (Pc) está determinada por la presión arterial (PA) y venosa (PV) y la relación de resistencias pre – a postcapilar (RA/RV) como se muestra por la ecuación :
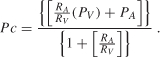
de la ecuación (4.1), es evidente que la presión capilar aumenta cuando la presión arterial o venosa aumenta y/o la relación de resistencia pre – a postcapilar cae. Dado que la presión arterial y venosa y la relación de resistencia pre-a-postcapilar se pueden modificar momento a momento en varios aspectos fisiológicos (p. ej., ej., inflamación) o tras la administración de fármacos vasoactivos, puede esperarse que la presión capilar y, por tanto, la tasa de filtración cerebrovascular puedan aumentar rápidamente de acuerdo con estos cambios. Sin embargo, se ha sugerido que la presión capilar puede estar estrechamente regulada en respuesta a cambios en la presión arterial o venosa, mediante ajustes apropiados en la resistencia pre o postcapilar, como medio para mantener un volumen de líquido intersticial relativamente constante cuando cualquiera de estas variables cambia ., Por ejemplo, debido a que el músculo liso vascular en las paredes arteriales y arteriolares se contrae cuando se expone a presiones intravasculares elevadas, esta respuesta miogénica aumenta la resistencia precapilar y protege los capilares de un aumento concomitante en su presión intravascular. Por el contrario, cuando la presión arterial cae, el tono miogénico se reduce en las arteriolas, disminuyendo su resistencia al flujo y manteniendo la presión capilar. Estas observaciones sugieren que la presión capilar puede ser regulada en el mismo rango de cambios de presión sobre el cual el flujo es autorregulado en un órgano dado., De hecho, a partir de la relación:

se podría predecir que la regulación del flujo sanguíneo (Q) estaría perfectamente acoplada a la regulación de la presión capilar, asumiendo que la presión venosa y la resistencia permanecen constantes., Sin embargo, un análisis extenso de los cambios en la relación de resistencia pre-a-postcapilar y los cambios en la presión capilar indicó que la efectividad del flujo y la regulación de la presión capilar no siempre están estrechamente correlacionadas, un efecto que puede deberse a Ajustes dimensionales pasivos en capilares y vénulas y alteraciones reológicas en la sangre que fluye a través de estos vasos como cambios en la presión arterial ., Además del efecto tampón de los ajustes en la relación de resistencia pre-a-postcapilar sobre la presión capilar, la influencia de los cambios en la presión capilar inducidos por alteraciones en la presión de perfusión se minimiza por cambios direccionalmente opuestos en el coeficiente de filtración capilar secundario al reclutamiento o descruitment de los capilares perfundidos .
de manera similar, los cambios en la presión capilar, y por lo tanto la filtración capilar, se amortiguan cuando la presión venosa es elevada . Al menos dos mecanismos explican esta regulación de la presión capilar (figura 4.1)., La contracción miogénica del músculo liso vascular en las paredes de las arteriolas es provocada por la transmisión del aumento de la presión venosa a estos vasos aguas arriba . Un reflejo venoso-arteriolar también ha sido implicado en esta respuesta, donde elevaciones en la presión venosa activan impulsos antidrómicos que se transmiten a las terminaciones nerviosas que afectan a las arteriolas aguas arriba, donde la liberación de neurotransmisores provoca constricción . Sin embargo, trabajos más recientes han cuestionado la importancia de este mecanismo versus la respuesta miogénica ., Es importante señalar que la presión capilar, y por lo tanto la filtración capilar, no está tan bien regulada en respuesta a los aumentos de la presión venosa o la resistencia como cuando se altera la presión arterial . Sin embargo, los posibles efectos del aumento de la presión venosa para reducir el coeficiente de filtración capilar pueden amortiguar la respuesta a la presión capilar alterada en el movimiento del fluido transmicrovascular, como se describió anteriormente.,
mientras que la discusión mencionada se centró en el efecto de los cambios agudos en la presión venosa sobre la regulación de la presión capilar y el movimiento del fluido transmicrovascular y se aplica a la mayoría de los órganos, la vasculatura del intestino delgado puede ser única en su respuesta a los cambios crónicos en la presión venosa. La hipertensión venosa intestinal crónica inducida por estenosis calibrada de la vena porta se asocia con el desarrollo de una circulación hiperdinámica caracterizada por aumento del gasto cardíaco, reducción de la resistencia vascular intestinal y aumento del flujo sanguíneo intestinal ., Estos últimos cambios resultan en un mayor aumento de la presión capilar intestinal que ocurre durante elevaciones de presión venosa aguda de la misma magnitud y se asocian con aumentos en el coeficiente de filtración capilar . Como consecuencia, el aumento de la filtración transcapilar es mucho mayor en la hipertensión venosa crónica versus aguda., Los mecanismos responsables de la reducción de la resistencia vascular intestinal que explican los cambios en la presión capilar y el coeficiente de filtración capilar que conducen a una mayor filtración capilar en la hipertensión portal crónica involucran la formación de sustancias vasodilatadoras y otros factores y son revisados en otra parte .
La presión capilar solo aumenta modestamente (~2 mmHg) en la hipertensión arterial crónica porque el aumento de la resistencia arterial que causa el aumento de la presión arterial amortigua la transmisión del aumento de la presión al nivel capilar ., Sin embargo, el aumento asociado en la tasa de filtración transmicrovascular explica en gran medida la elevada tasa de escape transcapilar de proteínas observada en este trastorno a través del acoplamiento convectivo de fluido y flujo proteico. La presión capilar elevada y la tasa de filtración ocurren temprano en el curso del desarrollo de la diabetes mellitus y se cree que es un estímulo importante para el engrosamiento de la membrana basal capilar, el sello distintivo ultraestructural de la microangiopatía diabética ., Se ha informado que la rarefacción Microvascular, o pérdida de capilares, acompaña el desarrollo de hipertensión arterial, diabetes mellitus y síndrome metabólico . Las reducciones concomitantes en el área de superficie disponible para el intercambio pueden compensar parcialmente el efecto de la hipertensión capilar para aumentar el volumen de líquido intersticial en estas Condiciones.
aumentos muy grandes en la presión venosa pueden inducir incrementos en la filtración capilar muy superiores a lo que se podría predecir a partir del aumento asociado en la presión capilar., Esto se debe a los aumentos inducidos por la presión en la permeabilidad microvascular que se manifiestan en la ecuación de Starling por aumentos en la conductividad hidráulica y reducciones en el coeficiente de reflexión osmótica., Para la mayoría de los órganos, las características de permeabilidad de la barrera microvascular al intercambio de fluidos y solutos insolubles en lípidos se pueden explicar por la existencia de un gran número de poros pequeños con radios de 70 angstroms o menos y un menor número de poros grandes con radios superiores a 200 angstroms, con algunos modelos que incorporan un tercer conjunto de poros muy pequeños (< 10 angstroms en radio) para dar cuenta del flujo difuso del agua., (Órganos como el hígado, que tienen capilares discontinuos caracterizados por grandes brechas entre las células endoteliales y coeficientes de reflexión cercanos a 0.1, no se ajustan a estos modelos). Se cree que los grandes aumentos en la presión venosa agrandan estos poros en la pared microvascular, que se conoce como el fenómeno de poro estirado . Los órganos individuales demuestran una sensibilidad diferencial al efecto de la presión venosa elevada con respecto a la inducción del fenómeno del estiramiento de los poros., Por ejemplo, no se produce un aumento de la permeabilidad en los microvasos de los pies durante el reposo, a pesar de que la presión capilar en los pies aumenta en más de 50 mmHg con respecto a los valores medidos en decúbito supino, debido a la gran columna hidrostática en arterias y venas. Sin embargo, los capilares pulmonares pueden demostrar un fenómeno de poro estirado durante condiciones como la insuficiencia ventricular izquierda, un efecto que exacerba la formación de edema pulmonar en esta condición .,
como se señaló anteriormente, la constricción miogénica de las arteriolas en respuesta a elevaciones de la presión arterial o venosa constituye un factor de seguridad importante contra la formación de edema en el edema hidrostático al limitar el aumento de la presión capilar y al reducir el número de capilares perfundidos, y por lo tanto el área de superficie disponible para la filtración de fluidos, que de otro modo podría ocurrir en respuesta a la hipertensión arterial o venosa o al aumento de la resistencia venosa (figura 4.1)., Sin embargo, es importante tener en cuenta que incluso los incrementos modestos en la presión capilar, que pueden parecer pequeños e intrascendentes, pueden resultar en aumentos sustanciales en las tasas de filtración de fluidos a través de la microvasculatura. Esto se debe a que la presión neta de filtración normal es bastante pequeña, con un promedio de 0,15 mmHg para un capilar prototípico del cuerpo. Por lo tanto, el aumento de la presión capilar en apenas 2 mmHg, como se señaló anteriormente en la hipertensión arterial, resulta en un aumento inicial de 14 veces en el movimiento del líquido desde la sangre hacia el intersticio., La hipertensión capilar resulta en la formación de un ultrafiltrado pobre en proteínas que al entrar en el espacio intersticial eleva el volumen del líquido intersticial. Debido a las características de cumplimiento del intersticio, pequeños incrementos en el volumen intersticial producen aumentos muy grandes en la presión tisular, lo que reduce efectivamente el gradiente de presión hidrostática transcapilar, limitando así la acumulación adicional de fluido (figura 4.1). Este efecto se exacerba en respuesta a elevaciones en la presión de salida venosa a través del fenómeno de abultamiento venoso., Es decir, el volumen en las venas aumenta inmediatamente con la elevación de la presión venosa, lo que produce un aumento coincidente de la presión intersticial causado por la expansión de vénulas y venas congestionadas en los espacios intersticiales (figura 4.1). En esencia, la congestión venosa desplaza la curva de cumplimiento intersticial hacia la izquierda, de modo que un menor cambio en el volumen intersticial produce un mayor aumento en la presión intersticial. El aumento de la presión del líquido intersticial aumenta el flujo linfático por tres mecanismos., En primer lugar, el aumento de la presión tisular proporciona la presión de conducción para el flujo en los linfáticos iniciales. En segundo lugar, el aumento de la presión en el compartimiento intersticial crea tensión radial en los filamentos de anclaje que conectan la matriz extracelular con las células endoteliales linfáticas, aumentando localmente el diámetro linfático inicial y abriendo espacios entre las uniones interdigitantes y superpuestas entre las células endoteliales linfáticas adyacentes (figura 3.1)., Estas fuerzas tensionales crean una presión de succión pequeña y transitoria para el movimiento del líquido intersticial a través de espacios agrandados entre las células endoteliales adyacentes, que actúan como un segundo sistema de válvula unidireccional para asegurar el flujo unidireccional desde el intersticio hacia los linfáticos. En tercer lugar, a medida que el líquido se mueve hacia los linfáticos iniciales, aumenta el volumen en los linfangiones aguas arriba, promoviendo su actividad contráctil y el flujo linfático. La presencia de válvulas entre los linfangiones adyacentes asegura un flujo unidireccional.,
como se señaló anteriormente, la hipertensión capilar resulta en el movimiento de líquido pobre en proteínas hacia los espacios intersticiales, reduciendo la concentración de proteínas tisulares y disminuyendo la presión osmótica coloide tisular (figura 4.1). Esto aumenta la eficacia del gradiente de presión oncótica transcapilar (nc-nt) en oposición al gradiente hidrostático (Pc − Pt) favoreciendo la filtración., Debido a que el soluto se excluye de una gran porción de agua en gel en la matriz extracelular, la rapidez de la disminución en la concentración de proteínas tisulares que se produce en respuesta al aumento del volumen de líquido intersticial se mejora, lo que aumenta la eficacia del lavado de proteínas como factor de seguridad del edema., Es importante señalar que la efectividad de las disminuciones en la presión osmótica tisular como factor de seguridad del edema se reduce en la hipertensión capilar severa, debido al fenómeno de poro estirado discutido anteriormente, que aumenta el transporte de proteínas acopladas por convección a los espacios tisulares.