An acid-base (proton transfer) reaction
para nuestro primer ejemplo de reactividad química, veamos una reacción muy simple que ocurre entre el ion hidróxido y el ácido clorhídrico:
HCl+OH^- \Rightarrow H_20+Cl^-
Esta es una reacción ácido-base: un protón se transfiere del HCl, el ácido, al hidróxido, la base. El producto es agua (el ácido conjugado del hidróxido) e ion cloruro (la base conjugada del HCl)., Usted sin duda ha visto esta reacción antes en la química general. A pesar de su simplicidad (y a pesar del hecho de que los reactivos y productos son inorgánicos en lugar de orgánicos), esta reacción nos permite considerar por primera vez muchas de las ideas fundamentales de la química orgánica que exploraremos en varios contextos a lo largo de este texto.
La clave para entender casi cualquier mecanismo de reacción es el concepto de densidad de electrones, y cómo está conectado con el movimiento de electrones (ruptura de enlaces y formación de enlaces) que ocurre en una reacción., El ion hidróxido – específicamente, el átomo de oxígeno electronegativo en el ion hidróxido-tiene una alta densidad electrónica debido a la carga negativa y la polaridad del enlace hidrógeno-oxígeno. El hidróxido de oxígeno es rico en electrones.

El átomo de hidrógeno en HCl, por otro lado, tiene baja densidad de electrones: es pobre en electrones. Como es de esperar, algo que es rico en electrones es atraído a algo que es pobre en electrones., A medida que el hidróxido y el HCl se acercan entre sí, un par solitario de electrones en el hidróxido de oxígeno rico en electrones es atraído por el protón pobre en electrones del HCl, y el movimiento de electrones ocurre hacia el protón. Los dos electrones en el enlace sigma hidrógeno-cloro son repelidos por esta densidad de electrones de hidróxido que se aproxima, y por lo tanto se alejan aún más del protón y hacia el núcleo de cloro., La consecuencia de todo este movimiento de electrones es que el enlace hidrógeno-cloro se rompe, ya que los dos electrones de ese enlace se liberan completamente del orbital 1s del hidrógeno y se convierten en un par solitario en el orbital 3p de un anión cloruro.
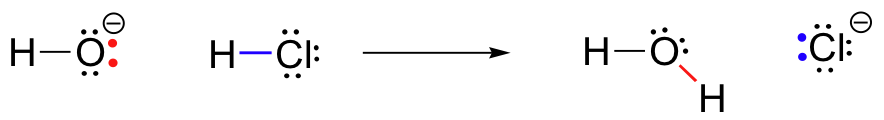
al mismo tiempo que el enlace hidrógeno-cloro se está rompiendo, se forma un nuevo enlace sigma entre hidrógeno y oxígeno, que contiene los dos electrones que anteriormente eran un par solitario en hidróxido. El resultado de esta formación de enlaces es, por supuesto, una molécula de agua.
Anteriormente (sección 6.1.,), vimos cómo se usaron flechas curvas para representar el movimiento de electrones que ocurre en reacciones químicas, donde los enlaces se rompen y se forman nuevos enlaces. La reacción HCl + OH, por ejemplo, se representa dibujando dos flechas curvas.
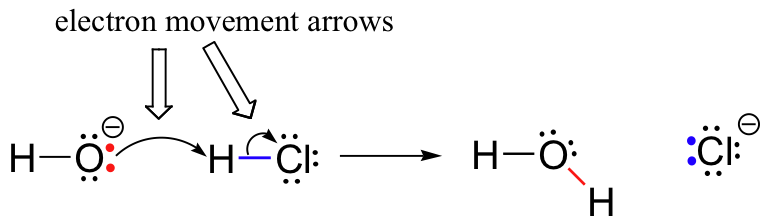
La primera flecha se origina en uno de los pares solitarios en el hidróxido de oxígeno y apunta al símbolo ‘H’ en la molécula de bromuro de hidrógeno, ilustrando el ‘ataque’ del par solitario de oxígeno y la posterior formación del nuevo enlace hidrógeno-oxígeno., La segunda flecha curvada se origina en el enlace hidrógeno-bromo y apunta al símbolo ‘Br’, lo que indica que este Enlace se está rompiendo: los dos electrones se’ van ‘ y se convierten en un par solitario en el ion bromuro.
es muy importante enfatizar en este punto que estas flechas curvadas de dos púas siempre representan el movimiento de dos electrones. La mayor parte de este libro estará dedicado a la descripción de los mecanismos de reacción que involucran el movimiento de dos electrones, por lo que estas flechas de cabeza completa se volverán muy familiares.,

en el segundo semestre, sin embargo, veremos los mecanismos de reacción radical, donde ocurre el movimiento de un solo electrón. Para estos procesos, se utilizará una flecha curvada de un solo púas (‘anzuelo’).
ejercicio
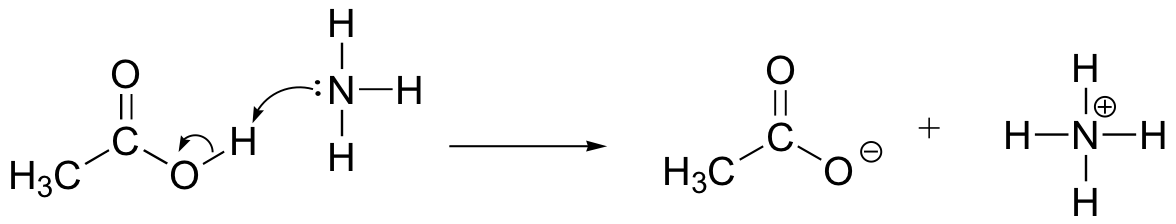
dibujar flechas de movimiento de electrones para ilustrar la reacción ácido-base entre el ácido acético, CH3COOH, y el amoníaco, NH3. Dibuje las estructuras completas de Lewis de reactivos y productos.