toutes les Collisions ne sont pas égales
pour un gaz à température ambiante et pression atmosphérique normale, il y a environ 1033 collisions dans chaque centimètre cube d’Espace chaque seconde. Si chaque collision entre deux molécules réactives donnait des produits, toutes les réactions seraient complètes en une fraction de seconde. Par exemple, lorsque deux boules de billard entrent en collision, elles rebondissent simplement l’une de l’autre., C’est le résultat le plus probable si la réaction entre A et B nécessite une perturbation ou un réarrangement significatif des liaisons entre leurs atomes. Afin de déclencher efficacement une réaction, les collisions doivent être suffisamment énergétiques (ou avoir suffisamment d’énergie cinétique) pour provoquer cette rupture de liaison. Ceci est discuté plus loin.
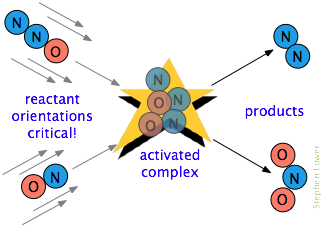
Il existe souvent une exigence supplémentaire. Dans de nombreuses réactions, en particulier celles impliquant des molécules plus complexes, les espèces réactives doivent être orientées d’une manière appropriée au processus particulier., Par exemple, dans la réaction en phase gazeuse de l’oxyde dinitrogen avec l’oxyde nitrique, L’extrémité oxygène du N2O doit atteindre l’extrémité azote du NO; modifier l’orientation de l’une ou l’autre molécule empêche la réaction. En raison de la randomisation étendue des mouvements moléculaires dans un gaz ou un liquide, il y a toujours assez de molécules correctement orientées pour que certaines molécules réagissent. Cependant, plus cette exigence d’orientation est critique, moins les collisions seront efficaces.,
Les collisions énergétiques entre molécules provoquent l’étirement et la courbure des liaisons interatomiques, les affaiblissant Temporairement de sorte qu’elles deviennent plus sensibles au clivage. La distorsion des liaisons peut exposer leurs nuages d’électrons associés à des interactions avec d’autres réactifs qui pourraient conduire à la formation de nouvelles liaisons.,
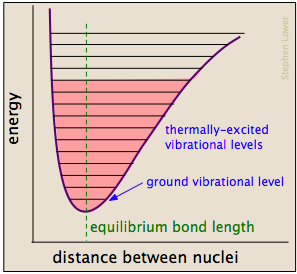
liaisons Chimiques ont certaines propriétés des ressorts mécaniques: leur potentiel en énergies dépendent de la mesure dans laquelle ils sont étirée ou compressée. Chaque liaison atome à atome peut être décrite par un diagramme d’énergie potentielle qui montre comment son énergie change avec sa longueur., Lorsque la liaison absorbe de l’énergie (par chauffage ou par collision), elle est élevée à un état vibratoire quantifié plus élevé (indiqué par les lignes horizontales) qui affaiblit la liaison car sa longueur oscille entre les limites étendues correspondant à la courbe.
une collision particulière excitera généralement un certain nombre de liaisons de cette manière. Dans environ 10-13 secondes, cette excitation est répartie entre les autres liaisons de la molécule de manière complexe et imprévisible qui peut concentrer l’énergie ajoutée à un point particulièrement vulnérable., La liaison affectée peut s’étirer et se plier plus loin, ce qui la rend plus sensible au clivage. Même si la liaison ne se rompt pas par étirement pur, elle peut se déformer ou se tordre de manière à exposer les nuages d’électrons voisins à des interactions avec d’autres réactifs susceptibles d’encourager une réaction.