l’oxyde ferrique, également appelé par son nom IUPAC trihydrate de fer ou oxyde de fer(III), est un composé inorganique représenté par la formule chimique Fe2O3 ou Fe2H6O3 . C’est l’un des oxydes de fer les plus importants, les deux autres étant respectivement l’oxyde ferrosoferrique (Fe3O4) et l’oxyde ferreux (FeO). Il se produit naturellement sous forme d’hématite minérale .,
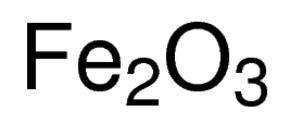
formule D’oxyde ferrique
oxyde ferrique hydraté
Il s’agit d’un composé gélatineux brun rougeâtre produit par addition d’alcali à des solutions contenant des sels de Fe(III). Il est également appelé oxyde ferrique hydraté et peut être chimiquement représenté soit comme Fe2O3.H2O ou Fe (O)OH . Certaines formes courantes de l’oxyde ferrique hydraté comprennent le lépidocrocite rouge qui se produit à l’extérieur dans les rusticules et la goethite orange qui se produit à l’intérieur des rusticules.,
comment est préparé L’oxyde ferrique
l’oxyde ferrique est synthétisé en laboratoire par électrolyse d’une solution de bicarbonate de sodium, qui agit comme un électrolyte inerte, et d’une anode de fer. La conversion électrolytique du fer en oxyde de fer (III) hydraté est représentée comme suit:
4FE + 3O2 + 2H2O → 4 FeO(OH)
l’oxyde de fer (III) hydraté, ainsi produit, subit une déshydratation à environ 200 °C pour former de l’oxyde ferrique .,
- FeS2 + 7O+ H2O → FeSO4 + H2SO4
- 2feso4 + H2SO4 + O → Fe2 (SO4) 3 + H2O
l’aluminium remplace le fer de L’oxyde ferrique
L’aluminium et l’oxyde ferrique subissent une réaction redox par laquelle le métal remplace oxyde d’aluminium:
Fe2O3 + 2Al → Al2O3 + 2FE
propriétés et caractéristiques de l’oxyde ferrique
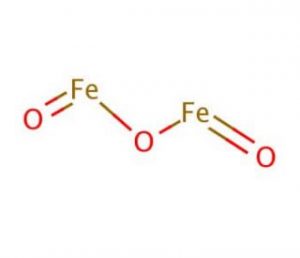
structure de l’oxyde ferrique
utilise
- dans les industries du fer pour production d’acier et d’alliages .,
- La poudre D’oxyde ferrique, également appelée rouge de bijoutier, est utilisée pour polir les lentilles et les bijoux métalliques .
- sa forme granulaire est utilisée comme milieu de filtration pour extraire les phosphates dans les aquariums d’eau salée .
- comme pigment Approuvé PAR LA FDA Brown 6 Et Pigment Red 101, pour une utilisation dans les cosmétiques .
- dans les applications biomédicales, car ses nanoparticules sont non toxiques et biocompatibles .
est-il dangereux
Une exposition prolongée à ses fumées ou poussières peut entraîner une pneumoconiose avec fièvre, frissons, courbatures, essoufflement et toux ., Un contact répété avec les yeux peut le décolorer et provoquer une coloration permanente du fer .
- oxyde de fer(III) – Chemspider.com
- oxyde ferrique Rouge – Pubchem.ncbi.nlm.hih.gov
- magnétite (Fe3O4) – Pubchem.ncbi.nlm.nih.gov
- oxyde ferreux – Pubchem.ncbi.nlm.nih.gov
- CHEBI: 50819-oxyde ferrique – Ebi.ac.uk
- poussières et fumées D’oxyde de fer (sous forme de Fe) – Cdc.gov
- cinétique et mécanisme de déshydratation de γ-FeOOH – Researchgate.net
- particules D’oxyde de fer(III) – Americanelements.com
- oxyde ferrique – Livre chimique.,com
- Propriétés magnétiques des matériaux – Sigmaaldrich.com
- oxyde de fer(III) – Chem.libretexts.org
- oxyde de fer (Fe2O3), Hydrate (composé) – Pubchem.ncbi.nlm.nih.gov
- l’oxydation du sulfate ferreux en sulfate ferrique au moyen d’air – Archive.org
- utilisations de L’oxyde de fer – Zjunited.com
- feuille D’information sur les substances dangereuses oxyde de fer – Nj.gov