une réaction acide-base (transfert de protons)
pour notre premier exemple de réactivité chimique, regardons une réaction très simple qui se produit entre l’ion hydroxyde et l’acide chlorhydrique:
HCl+OH^- \Rightarrow Cl^-
il s’agit d’une réaction acide-base: un proton est transféré du HCl, l’acide, à l’hydroxyde, la base. Le produit est l’eau (l’acide conjugué de l’hydroxyde) et l’ion chlorure (La base conjuguée du HCl)., Vous avez sans aucun doute déjà vu cette réaction en chimie générale. Malgré sa simplicité (et malgré le fait que les réactifs et les produits sont inorganiques plutôt qu’organiques), cette réaction nous permet de considérer pour la première fois bon nombre des idées fondamentales de la chimie organique que nous explorerons dans divers contextes tout au long de ce texte.
la clé pour comprendre à peu près n’importe quel mécanisme de réaction est le concept de densité électronique, et comment il est connecté au mouvement électronique (rupture de liaison et formation de liaison) qui se produit dans une réaction., L’ion hydroxyde – en particulier, l’atome d’oxygène électronégatif dans l’ion hydroxyde-a une densité électronique élevée en raison de la charge négative et de la polarité de la liaison hydrogène-oxygène. L’oxygène hydroxyde est riche en électrons.

l’atome d’hydrogène dans HCl, quant à lui, a une faible densité électronique: il est pauvre en électrons. Comme vous pouvez vous y attendre, quelque chose qui est riche en électrons est attiré par quelque chose qui est pauvre en électrons., Lorsque l’hydroxyde et le HCl se rapprochent l’un de l’autre, une seule paire d’électrons sur l’oxygène hydroxyde riche en électrons est attirée par le proton pauvre en électrons du HCl, et un mouvement d’électrons se produit vers le proton. Les deux électrons de la liaison sigma hydrogène-chlore sont repoussés par cette densité électronique d’hydroxyde approchant, et s’éloignent donc encore plus du proton et vers le noyau de chlore., La conséquence de tout ce mouvement d’électrons est que la liaison hydrogène-chlore est rompue, car les deux électrons de cette liaison se détachent complètement de l’orbitale 1s de l’hydrogène et deviennent une paire solitaire dans l’orbitale 3p d’un anion chlorure.
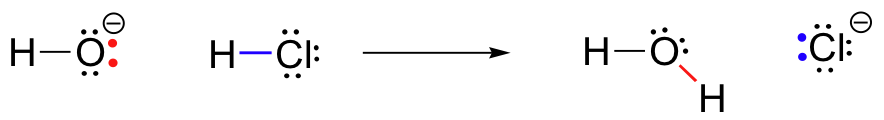
en même temps que la liaison hydrogène-chlore se brise, une nouvelle liaison sigma se forme entre l’hydrogène et l’oxygène, contenant les deux électrons qui formaient auparavant une seule paire sur l’hydroxyde. Le résultat de cette formation de liaison est, bien sûr, une molécule d’eau.
précédemment (section 6.1.,), nous avons vu comment les flèches courbes ont été utilisées pour représenter le mouvement des électrons qui se produit dans les réactions chimiques, où les liaisons sont brisées et de nouvelles liaisons sont formées. La réaction HCl + OH, par exemple, est représentée en dessinant deux flèches courbes.
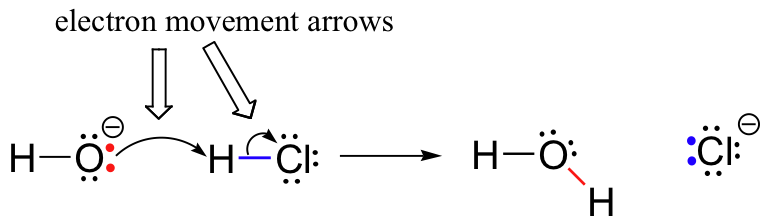
La première flèche provient de l’une des paires isolées sur l’hydroxyde oxygène et pointe vers le symbole » H « dans la molécule de bromure d’hydrogène, illustrant l ‘ « attaque » de la paire isolée oxygène et la formation ultérieure de la nouvelle liaison hydrogène-oxygène., La deuxième flèche courbe provient de la liaison hydrogène-brome et pointe vers le symbole « Br », indiquant que cette liaison se brise – les deux électrons « partent » et deviennent une paire solitaire sur l’ion bromure.
Il est très important de souligner à ce stade que ces flèches incurvées à deux barbelés représentent toujours le mouvement de deux électrons. La majeure partie de ce livre sera consacrée à la description des mécanismes de réaction impliquant un mouvement à deux électrons, de sorte que ces flèches à tête pleine deviendront très familières.,

Au deuxième semestre, cependant, nous examinerons les mécanismes de réaction radicalaires, où le mouvement d’un seul électron se produit. Pour ces processus, une flèche incurvée à un seul barbelé (« hameçon ») sera utilisée.
exercice
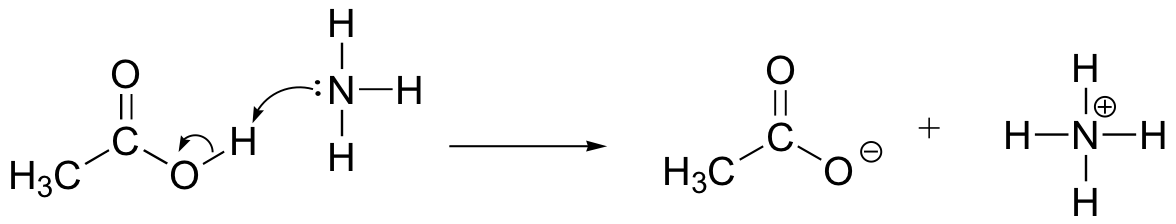
dessinez des flèches de mouvement d’électrons pour illustrer la réaction acide-base entre l’acide acétique, CH3COOH, et l’ammoniac, NH3. Dessinez les structures de Lewis complètes des réactifs et des produits.