Introduction
Les cellules stromales dérivées D’Adipose (ASCs) sont multipotentes et immunodéprimées, ce qui en fait des candidats idéaux à des fins thérapeutiques (Bourin et al., 2013; Ma et coll., 2014; Kallmeyer et Pepper, 2015). Les ASCs peuvent être isolés à l’aide de techniques peu invasives à partir de divers dépôts de tissus adipeux dans le corps (Zuk et al., 2001)., Ils sont caractérisés par leur capacité à adhérer au plastique, un profil de marqueur de surface unique et la capacité de se différencier en os, graisse et cartilage (Dominici et al., 2006; Bourin et coll., 2013). Les ASC comprennent ~15-30% de la fraction vasculaire stromale (SVF) du tissu adipeux (Bourin et al., 2013; Zuk, 2013), et doivent être élargis ex vivo afin d’obtenir un nombre de cellules suffisant à des fins thérapeutiques.,
fournir des produits de thérapie cellulaire sûrs et réglementés aux patients nécessite le respect des bonnes pratiques de fabrication (BPF), et les directives BPF doivent être respectées tout au long du processus d’isolement, d’expansion et de différenciation des ASC (Giancola et al., 2012). Les nombreux réactifs utilisés pour isoler et développer les ASC à des fins de recherche sont d’origine animale ou ne sont pas de qualité clinique; par conséquent, ils doivent être remplacés par des solutions de rechange plus appropriées conformément aux normes BPF (Halme et Kessler, 2006; Riis et al., 2015)., Nous examinons le choix de la supplémentation sérique qui peut être utilisée pour l’expansion du NCP au lieu du sérum fœtal bovin (SCF), et décrivons leurs effets in vitro et in vivo tels que rapportés dans la littérature.,
la Société Internationale de Thérapie Cellulaire (ISCT) et International de la Graisse de la Technologie Appliquée de la Société (IFATS) les lignes Directrices et les Techniques Utilisées pour Évaluer Adipeux Dérivé des Cellules Stromales Caractéristiques
Un ensemble de critères minimaux et des lignes directrices ont été recommandés par la Société Internationale de Thérapie Cellulaire (ISCT) et International de la Graisse de la Technologie Appliquée de la Société (IFATS) pour la caractérisation des Cra (Dominici et coll., 2006; Bourin et coll., 2013)., Ces critères comprennent la capacité des ASC à adhérer au plastique, leur profil de marqueur de surface et leur potentiel de différenciation du trilineage. Le dernier document de position décrit la viabilité et la prolifération comme des mesures supplémentaires aux critères de caractérisation originaux. De plus, des méthodes expérimentales et des essais ont été définis pour mesurer les critères de caractérisation (Bourin et al., 2013)., Il a été démontré que ces critères sont affectés par de nombreux facteurs tels que la technique de liposuccion, la technique D’isolement SVF et le milieu et la supplémentation utilisés pendant le processus d’expansion (Koellensperger et al., 2014; Bajek et coll., 2015; Busser et coll., 2015). Selon les lignes directrices de L’ISCT et de L’IFATS, il est recommandé et accepté que la pratique de recherche confirme le respect des lignes directrices ci-dessus pour chaque condition d’isolement et de culture afin de classer la population cellulaire résultante en ASC.,
Techniques et méthodes utilisées pour caractériser les ASC
morphologie et adhérence
Une fois ensemencées, les ASC adhérentes présentent une morphologie distincte, qui peut être décrite comme mince, allongée et en forme de fuseau. L’évaluation morphologique des ASCs est généralement préformée par microscopie optique (Trojahn Kølle et al., 2013).
prolifération
Les lignes directrices de L’ISCT et de L’IFATS ont recommandé que la prolifération et la fréquence des ACSs progéniteurs soient mesurées par un test d’Unité de formation de colonies fibroblastoïdes (Bourin et al., 2013)., D’autres techniques utilisées dans les études citées dans cette revue utilisent le comptage de cellules viables ou la mesure de la capacité proliférative des ASC par immunohistochimie. Les méthodes de comptage comprennent (1) le comptage des cellules à l’aide d’un colorant de viabilité et d’un hémocytomètre, (2) le comptage des cellules à l’aide de billes de comptage ou de techniques de coloration et d’une analyse cytométrique en flux, et (3) l’utilisation de tests colorimétriques qui mesurent les cellules viables dans un spectrophotomètre (Gharibi et Hughes, 2012; , 2013; Bogdanova et coll., 2014; Atashi et coll., 2015; Johal et coll., 2015; Oikonomopoulos et coll., 2015).,
Immunophénotype
Les lignes directrices de L’ISCT et de L’IFATS ont énuméré l’expression de plusieurs marqueurs de surface et leurs pourcentages attendus comme une exigence ferme dans leur énoncé de position. Ils ont également recommandé que l’expression des marqueurs de surface soit mesurée par coloration d’anticorps multicolores (Bourin et al., 2013). Les études de cette revue ont utilisé l’analyse cytométrique en flux pour mesurer l’expression des marqueurs de surface (Müller et al., 2006; Lindroos et coll., 2009; Chieregato et coll., 2011; Josh et coll., 2012; Trojahn Kølle et coll., 2013; Bogdanova et coll., 2014; Patrikoski et coll., 2014).,
différenciation du Trilineage
La différenciation en adipose, os et cartilage a traditionnellement été mesurée à l’aide de techniques de coloration histochimique visualisées au microscope; cependant, les lignes directrices de L’ISCT et de L’IFATS ont recommandé que les évaluations qualitatives soient remplacées ou complétées par des approches quantitatives telles que la mesure de l’expression, 2013)., Les techniques qui ont été utilisées pour mesurer la capacité de différenciation, décrites dans les études citées dans cette revue, ont varié de la coloration histochimique, à la PCR conventionnelle et RT-qPCR. Les techniques de coloration histochimique comprennent la coloration des cellules avec (1) du rouge O et du rouge Nil pour l’adipogenèse; (2) du rouge Alizarine S, de la phosphatase alcaline et de von Kossa pour l’ostéogenèse; ou (3) du bleu Alcian et de la safranine pour la chondrogenèse (Müller et al., 2006; Kocaoemer et coll., 2007; Hebert et coll., 2010; Rajala et coll., 2010; Koellensperger et coll., 2014; Oikonomopoulos et coll., 2015; Riis et coll., 2016).,
supplémentation sérique
sérum fœtal bovin
Le FBS est le supplément sérique traditionnel utilisé pour la culture cellulaire. FBS contient des facteurs de croissance (GFs) et d’autres éléments essentiels pour l’attachement, l’expansion, le maintien et la prolifération des ASC in vitro (Lennon et al., 1995, 1996; Zuk et coll., 2001; van der Valk et coll., 2010). Le FBS est sujet à la variation de lot en lot, à la xénoimmunisation et à la contamination possible par des mycoplasmes, des virus, des endotoxines et des prions (van der Valk et al., 2004, 2010; Chieregato et coll., 2011; Kyllonen et coll., 2013; Jin et coll., 2015)., La source et la qualité du SGF peuvent affecter la prolifération et la différenciation des ASCs, et le dépistage systématique des mycoplasmes, des endotoxines et des virus est devenu important (Naaijkens et al., 2012). Ces facteurs peuvent affecter les résultats expérimentaux et rendre le produit cellulaire dangereux pour un usage clinique (Zuk et al., 2001; van der Valk et coll., 2004; Witzeneder et coll., 2013).
Les ASC sont immunodéprimés, dépourvus de l’expression du complexe majeur d’histocompatibilité de classe II ainsi que des molécules costimulatrices des cellules T et B (CD80, CD86 et CD40)., L’immunogénicité in vitro et les propriétés immunosuppressives des ASCs sont généralement mesurées en co-cultivant les ASCs avec des cellules mononucléées du sang périphérique dans des réactions lymphocytaires mixtes et en mesurant la réponse proliférative des lymphocytes T (McIntosh et al., 2006; Patrikoski et coll., 2014). Les ASCs démontrent des propriétés immunomodulatrices et immunosuppressives, comme le démontre leur capacité à réguler la fonction des lymphocytes T et à moduler la sécrétion de cytokines in vitro et in vivo (Leto Barone et al., 2013; Roemeling-van Rhijn et coll., 2013; Patrikoski et coll., 2014)., Ces propriétés découlent de la faible immunogénicité des Cra. La majorité des ASC et d’autres essais cliniques de cellules souches mésenchymateuses (MSC) (phase I, II et III) utilisent des milieux additionnés de FBS, et il a été rapporté que des effets immunogènes sont induits par des composants de FBS chez des sujets humains (Sundin et al., 2007; Riis et coll., 2015). Par exemple, un essai clinique utilisant MSCs dérivés de la moelle osseuse (BM-MSCs) élargi dans FBS trouvé des anticorps contre les composants de FBS (Horwitz et al., 2002)., Des réponses immunitaires à FBS telles que Arthus et des réactions anaphylactiques ont été rapportées dans des essais cliniques, où les patients ont été traités avec des cellules dendritiques et des lymphocytes exposés à FBS (Selvaggi et al., 1997; Mackensen et coll., 2000). En revanche, une méta-analyse des essais cliniques MSC a révélé que plus de 75% des expériences utilisaient FBS dans leurs protocoles d’expansion cellulaire et qu’une seule étude surveillait et démontrait des effets indésirables au FBS (Lalu et al., 2012)., Les études in vivo examinant la réponse immunitaire des souris aux ASCs ont montré une immunosuppression et une immunomodulation préservées, une faible immunogénicité et aucune réaction au SGF (Cho et al., 2009; González et coll., 2009). Bien que les ASC soient largement testés dans le cadre d’essais cliniques, leur utilisation définitive en tant qu’agent thérapeutique reste à établir. Ceci est encore aggravé par l’utilisation de modèles précliniques qui peuvent ne pas être biologiquement pertinents (Monsarrat et al., 2016). En outre, le FBS peut être moins immunogène chez la souris et d’autres modèles animaux que chez l’homme., Enfin, la réponse immunitaire provoquée par FBS (Selvaggi et al., 1997; Mackensen et coll., 2000; Horwitz et coll., 2002) pourrait influencer le rejet des cellules transplantées en thérapie cellulaire.
Alternatives sans sérum
la composition inconnue et non définie de FBS est un inconvénient majeur. Une alternative préférable serait un milieu défini chimiquement avec une composition connue telle que les milieux sans sérum (SF) ou XF disponibles dans le commerce (Usta et al., 2014)., Ces milieux sans sérum sont supposés à tort être dépourvus de tout produit animal puisque les Termes SF et XF sont souvent utilisés de manière interchangeable. Cependant, les milieux de SF sont généralement complétés par de l’albumine sérique d’origine animale ou humaine et des GFs en quantités indéterminées (Patrikoski et al., 2013). Les milieux sans Xeno, d’autre part, sont des milieux chimiquement définis contenant des composants bien définis à des concentrations spécifiques (Usta et al., 2014).
facteurs de croissance
Une autre alternative au sérum est l’ajout de GFs au milieu de culture, soit isolément, soit sous forme de cocktail., Ces GFs peuvent être synthétiques, d’origine animale ou humaine. Le remplacement par des FG synthétiques est préférable en raison de leur meilleure qualité et en raison de la normalisation entre les lots, ce qui peut ne pas être possible pour les FG d’origine animale ou humaine. Les FG couramment utilisés sont le facteur de croissance des fibroblastes, le facteur de croissance épidermique et le facteur de croissance dérivé des plaquettes (PDGF; Baer et Geiger, 2012; Ahearne et al., 2014). L’ajout de GFs a été lié à une augmentation de la prolifération (Hebert et al., 2010; Gharibi et Hughes, 2012)., Un potentiel de différenciation adipogène amélioré a déjà été rapporté dans des ASCs élargis dans un milieu complété par du GF (Hebert et al., 2010). Cependant, une autre étude a observé un effet négatif sur la différenciation adipogène et ostéogénique dans les ASC cultivées à long terme (Gharibi et Hughes, 2012).
albumine sérique
L’albumine sérique est une protéine plasmatique abondante et peut être isolée des humains et des animaux. Souvent, les médias SF sont complétés par de l’albumine sérique., Des études comparant l’albumine sérique humaine pour la supplémentation en milieu ASC ont révélé une prolifération améliorée, une morphologie plus petite en forme de fuseau et une différenciation préservée en adipeux, os et cartilage (Rajala et al., 2010; Johal et coll., 2015).
milieu XF chimiquement défini
le milieu Xeno-free a été recommandé en remplacement de la FBS et du sérum, car il contient les composants nécessaires à l’expansion des ASC, n’implique pas de variation entre donneurs ou lots, est conforme aux BPF et présente une immunogénicité minimale et une immunosuppression favorable (van der Valk et al., 2004, 2010; Usta et coll.,, 2014). Par rapport à FBS, l’utilisation du milieu XF pour l’expansion des ASCs a conduit à une meilleure qualité morphologique, une prolifération accrue, un immunophénotype comparable et une différenciation en adipeux, os et cartilage (Lindroos et al., 2009; Patrikoski et coll., 2013; Oikonomopoulos et coll., 2015). L’utilisation de supports XF dans l’expansion des ASC fait perdre aux ASC leur capacité à adhérer au plastique (Kyllonen et al., 2013; Patrikoski et coll., 2013; Oikonomopoulos et coll., 2015). Des agents de revêtement supplémentaires sont nécessaires pour maintenir la caractéristique inhérente à l’adhérence plastique associée aux ASC., Le milieu XF disponible dans le commerce est coûteux et la préparation du milieu XF interne peut prendre beaucoup de temps et augmenter le risque de variation d’un lot à l’autre (Lund et al., 2009; Baer et coll., 2010; Rajala et coll., 2010; Yang et coll., 2012; Kyllonen et coll., 2013; Patrikoski et coll., 2013; Oikonomopoulos et coll., 2015).
Alternatives humaines
Les alternatives humaines peuvent remplacer les milieux FBS et SF/XF complétés et peuvent créer un environnement de culture qui ressemble plus exactement à l’environnement humain (Azouna et al., 2012; Koellensperger et coll., 2014)., En outre, l’utilisation de produits autologues (dérivés du même individu) évite la nécessité de tester les agents infectieux et autres agents pathogènes.
sérum humain
Après que le sang total a été autorisé à coaguler en l’absence d’anticoagulant et a été centrifugé, le sérum est la partie liquide résultante qui ne contient pas de plaquettes, de globules blancs ou de globules rouges (Figure 1; Stedman, 2006). Le sérum humain (HS) peut être autologue (le donneur et le receveur sont le même individu) ou allogénique (dérivé d’individus différents du receveur)., Les HS autologues et allogéniques sont supérieurs aux FBS (Stute et al., 2004; Bieback et coll., 2009, 2012; Bernardo et coll., 2011; Kyllonen et coll., 2013; Patrikoski et coll., 2013). Les ASCs développés dans le HS ont une plus grande stabilité du transcriptome que ceux développés dans le FBS, tandis que les gènes responsables de l’allongement du cycle cellulaire, de la différenciation et de la matrice extracellulaire et de la synthèse des prostaglandines sont régulés à la hausse et surexprimés dans le FBS par rapport au HS à l’aide d’une analyse, 2005)., Les ASCs élargis dans le FBS ont atteint la sénescence plus tôt et ont montré un raccourcissement des télomères par rapport aux ASCs élargis dans le HS (Shahdadfar et al., 2005). Le choix de HS semble avoir peu d’effet sur les propriétés immunomodulatrices des ASCs. Les ASC dilatées dans des milieux contenant du HS allogénique ou du FBS avaient une faible immunogénicité et entraînaient une immunosuppression (Patrikoski et al., 2014). Les ASC développées dans les HS autologues ou allogéniques présentent une plus grande prolifération et un immunophénotype indiscernable par rapport aux ASC développées dans les FBS (Josh et al., 2012; Bogdanova et coll., 2014)., Les ASCs élargis dans les HS allogéniques ont été différenciés en adipeux, os et cartilage, bien que la régulation à la hausse des gènes chondrogènes et ostéogéniques ait été favorisée par rapport aux FBS (Josh et al., 2012). Les ASC élargies dans les HS autologues ont été différenciées en adipeux et en cartilage; cependant, la capacité à se différencier en os était moins favorisée (Bogdanova et al., 2014). Les HS autologues peuvent fournir des ASC avec une meilleure prolifération et stabilité génomique telle que déterminée par l’analyse de microréseaux par rapport aux HS allogéniques (Shahdadfar et al., 2005; Bieback et coll., 2009; Bernardo et coll., 2011)., Les ASC se sont développées dans les HS allogéniques sont entrées en arrêt de croissance et ont subi une mort cellulaire (Shahdadfar et al., 2005; Lindroos et coll., 2009), ce qui limite les avantages potentiels de l’HS allogénique. Bien que le HS autologue puisse être idéal, sa disponibilité est limitée et il peut y avoir des variations significatives entre les patients dans la capacité de leur propre sérum à soutenir la croissance de leurs propres cellules (Lange et al., 2007). Alternativement, le HS allogénique peut être mis en commun, ce qui donne de plus grandes quantités pour l’expérimentation en laboratoire et peut subir des tests de qualité rigoureux par une banque de sang (par exemple,, tests pour l’absence d’agents infectieux et la contamination par d’autres cellules sanguines) avant l’utilisation chez l’homme (Bieback et al., 2009).
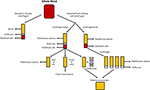
la Figure 1. Production des différentes alternatives humaines. Le sérum est produit lorsque le sang total est autorisé à coaguler et centrifugé pour granuler les globules rouges et blancs et les plaquettes. Le Plasma est produit par la prévention de la coagulation suivie d’une centrifugation., Selon la vitesse de centrifugation, on produit un plasma pauvre en plaquettes (ppp; centrifugation rapide) ou un plasma riche en plaquettes (PRP; centrifugation plus lente). Si le PPP est stocké à -18°C, il est appelé plasma frais congelé. Les concentrés plaquettaires peuvent être produits soit en prenant le plasma pauvre en plaquettes et 4 couches buffy et en les mettant en commun, soit en centrifugeant plusieurs PRP et en mettant en commun les pastilles plaquettaires (en suspension dans une petite quantité de plasma) ensemble.,
Plasma
le Plasma est la partie liquide non cellulaire du sang qui contient de l’eau, des électrolytes et des protéines (facteurs de coagulation, fibrinogène et anticoagulants). Le plasma pauvre en plaquettes (PPP), le plasma frais congelé (FFP) et le plasma riche en plaquettes (PRP; Figure 1) peuvent être obtenus à partir de sang total par centrifugation à différentes vitesses et stockage ultérieur à différentes températures. La sécrétion de GF peut être améliorée en activant les plaquettes dans le sang total avec de la thrombine avant la centrifugation (Doucet et al., 2005; Kocaoemer et coll.,, 2007), améliorant ainsi l’activité des produits plasmatiques.
Plasma pauvre en plaquettes
le PPP est presque exempt de plaquettes et est produit à partir du sang total par addition d’un anticoagulant pendant le processus de collecte, après quoi le plasma est séparé par centrifugation rapide (Figure 1; Koellensperger et al., 2006). Cela permet aux plaquettes et aux globules rouges d’être granulés. Le PPP résultant est stocké à 4°C et est appelé plasma frais., Le PDGF est sécrété par les plaquettes agrégatrices; cependant, le PDGF négligeable est libéré dans le PPP en raison du petit nombre de plaquettes résiduelles. GFs peut donc devoir être ajouté à PPP lorsqu’il est utilisé dans les médias comme c’est le cas lors de l’utilisation du milieu SF (Müller et al., 2006; Gottipamula et coll., 2013). L’utilisation de PPP sans ajout de GFs a entraîné des taux de prolifération plus faibles et une augmentation plus faible de la synthèse de l’ADN mesurée à l’aide de l’incorporation de thymidine, par rapport à HS et FBS (Vogel et al., 1980; Koellensperger et coll., 2006)., PPP avec GFS ajouté a entraîné une augmentation des taux de prolifération par rapport à HS (Koellensperger et al., 2006); cependant, ces différences pourraient provenir de différents protocoles de production de PPP et de l’ajout de niveaux variables de GFs à chacune des préparations de PPP dans la présente étude. L’Expansion des ASCs dans les PPP entraîne une prolifération améliorée par rapport au FBS, et présente une différenciation ostéogénique comparable à celle des ASCs élargis dans le HS (Koellensperger et al., 2014)., La différenciation chondrogénique a diminué dans les ASC élargies en PPP par rapport aux ASC élargies en PRP (Koellensperger et al., 2014).
Plasma frais congelé
Le FFP est obtenu de la même manière que le PPP, mais il est congelé directement après séparation à -18°C (O’Shaughnessy et al., 2004; Liumbruno et coll., 2009). FFP a été utilisé dans l’expansion de BM-MSCs avec des résultats positifs., Ces résultats comprennent une meilleure prolifération, une activité immunosuppressive et une différenciation en adipocytes et ostéocytes; et un immunophénotype et une morphologie comparables aux cellules élargies dans FBS (Müller et al., 2006; Mannello et Tonti, 2007). Cependant, l’utilisation de FFP comme substitut sérique dans l’expansion de L’ASC nécessite une investigation plus approfondie.
Plasma riche en plaquettes
le PRP est la partie du sang qui est enrichie en plaquettes. La PRP est produite en séparant le plasma des globules rouges à des vitesses de centrifugation plus lentes, ce qui empêche la granulation des plaquettes (Figure 1)., Les ASCs développés dans le PRP maintiennent un immunophénotype et une morphologie classiques, et le PRP augmente la prolifération par rapport au FBS (Kocaoemer et al., 2007; Chieregato et coll., 2011; Atashi et coll., 2015). Les ASCs élargis dans le PRP ont amélioré l’efficacité de différenciation vers les lignées adipogènes et ostéogéniques, tout en ayant une efficacité comparable pour la différenciation chondrogène, par rapport aux ASCs élargis dans le FBS (Kocaoemer et al., 2007; Chieregato et coll., 2011). En comparaison, le HS s’est révélé légèrement meilleur que le PRP en termes de différenciation et de prolifération des ASCs (Kocaoemer et al.,, 2007; Chieregato et coll., 2011). Le PRP est un complément de milieu de culture mal défini en raison de sa variabilité biologique élevée et de sa procédure d’extraction compliquée, dans laquelle il peut être difficile de purifier le surnageant riche en facteurs plaquettaires des membranes plasmatiques. L’utilisation du PRP est limitée par les grandes quantités de sang total nécessaires pour produire suffisamment de PRP pour l’expérimentation (Chieregato et al., 2011).,
lysat plaquettaire
le lysat plaquettaire humain (HPL) contient des GF plaquettaires qui sont obtenus par lyse de plaquettes concentrées dans un petit volume de plasma (concentrés plaquettaires; Figure 1) par choc thermique. HPL contient une concentration plus élevée de GFs que d’autres substituts sériques, y compris le PRP humain et le FBS (Doucet et al., 2005; Bernardo et coll., 2006, 2011; Bieback et coll., 2009; Schallmoser et coll., 2010)., La HPL peut facilement être obtenue et produite à partir de produits d’aphérèse et de couches buffy, et peut être remise en suspension dans du PRP ou une solution additive (Schallmoser et Strunk, 2013; Iudicone et al., 2014). La HPL est produite par congélation des plaquettes à une température comprise entre -30 et -80°C pendant 24 h, suivie d’une étape de décongélation et de centrifugation. Les cycles répétés de gel, de dégel et de centrifugation permettent la libération de GFs et l’élimination des corps plaquettaires (Bernardo et al., 2006; Schallmoser et coll., 2007)., Un autre avantage de la supplémentation en HPL est que les plaquettes peuvent être utilisées après la date d’expiration de 4 à 5 jours du sang mis en banque (Bieback et al., 2009). HPL est une meilleure alternative que les HS autologues et allogéniques, car les ASC développées dans HPL conservent leur immunophénotype Classique, leur différenciation, leur efficacité clonogène, leur pureté cellulaire et leur viabilité cellulaire (Trojahn Kølle et al., 2013; Riis et coll., 2016). HPL prend également en charge l’expansion à long terme sans compromettre les propriétés immunomodulatrices des ASCs, telles que mesurées par analyse cytométrique en flux (Bieback et al., 2009)., L’Expansion de HPL entraîne un temps de doublement de la population plus court, ce qui réduit le temps nécessaire à l’expansion cellulaire et réduit la menace de sénescence et de transformation (Doucet et al., 2005; Shahdadfar et coll., 2005; Bernardo et coll., 2006, 2011; Azouna et coll., 2012). La biosécurité de HPL a été évaluée à l’aide de l’hybridation génomique comparative array et du caryotypage spectral à haute sensibilité, où il a été constaté que les ASCs élargis dans HPL ne présentaient aucune aberration chromosomique (Crespo-diaz et al., 2011; Trojahn Kølle et coll., 2013)., La morphologie Classique des ASC (minces, plus petites, allongées et en forme de fuseau) est maintenue chez HS et HPL, tandis que les ASC élargies chez FBS sont plus grandes et moins en forme de fuseau (Trojahn Kølle et al., 2013). Bien que cela puisse indiquer que HS et HPL choisissent pour les ASCs primitifs / immatures (Doucet et al., 2005; Bieback et coll., 2009), il suggère également que les cellules cultivées dans FBS ont réduit la prolifération et progressent plus rapidement vers la sénescence. HPL varie selon les individus (Bernardo et al., 2006; Crespo-diaz et coll., 2011), et la variation d’un lot à l’autre est réduite lorsque la HPL est mise en commun (Schallmoser et al.,, 2007; Trojahn Kølle et coll., 2013). De plus, en mettant en commun de nombreux donneurs, une grande quantité peut être obtenue pour la supplémentation, ce qui rend le HPL préférable au PRP (Kocaoemer et al., 2007; Bieback et coll., 2009; Chieregato et coll., 2011).
Conclusion
Selon Riis et coll. de tous les essais cliniques enregistrés utilisant des ASC élargis qui ont énuméré leurs conditions d’expansion, la majorité utilisent le FBS, trois essais utilisent le HS autologue, un essai utilise le PRP et un essai utilise le HPL (Riis et al., 2015)., Ces statistiques sont alarmantes, car le FBS a le potentiel de transmettre des maladies zoonotiques à la suite d’une transplantation cellulaire, et des réactions immunitaires contre les composants du FBS ont été rapportées (Selvaggi et al., 1997; Mackensen et coll., 2000). Le FBS est un produit non conforme aux BPF, car il affecte la sécurité et l’efficacité du traitement ASC, et doit donc être remplacé (van der Valk et al., 2004; Kyllonen et coll., 2013; Witzeneder et coll., 2013). On y a remédié en remplaçant le FBS par des solutions de remplacement d’origine humaine définies chimiquement., Le passage de FBS à des alternatives humaines ou à des milieux XF/SF en médecine régénérative présente l’avantage important que les ASC prolifèrent beaucoup plus rapidement dans ces derniers, ce qui entraîne un plus grand nombre de cellules à transplanter dans un temps plus court. Cependant, la supériorité relative des différents milieux de culture est encore largement débattue. Des études comparant plus d’un milieu de culture ont rapporté des résultats variables (Lange et al., 2007; Bernardo et coll., 2011; Koellensperger et coll., 2014; Riis et coll., 2016). Koellensperger et coll., par comparaison, la différenciation en Trilineage des ASCs s’est développée dans FBS, PRP, PPP et HS (Koellensperger et al., 2014). Leurs résultats ont révélé que chaque milieu de culture permettait la différenciation en une ou plusieurs lignées, mais jamais en trois lignées. Lorsque les médias XF, FBS et HPL ont été comparés, Riis et al. on a constaté que certaines sous-populations exprimaient des marqueurs de surface spécifiques en fonction du milieu de culture utilisé (Riis et al., 2016)., Des études comparant l’immunophénotype des ASCs dilatés dans le FBS et les autres milieux de culture ont révélé peu ou pas de différence dans l’expression des marqueurs de surface cellulaire, quels que soient les marqueurs étudiés (Tableau 1). La densité d’ensemencement, la tension d’oxygène, la confluence, la dissociation et le choix des milieux basaux peuvent également influencer les résultats expérimentaux (Sotiropoulou et al., 2006; Freshney, 2010; Bourin et coll., 2013; Inamdar et Inamdar, 2013; Feng et coll., 2014; Riis et coll., 2015)., Le choix du milieu de culture dépend de l’application en aval de ces cellules (administration d’ASC différenciées ou non différenciées) et de la condition traitée. De plus, l’immunogénicité du milieu de culture utilisé pour développer les cellules avant l’application clinique doit être considérée comme un paramètre susceptible d’influencer le résultat clinique. La plupart des études comparant différents milieux de culture ont utilisé les critères spécifiés par L’ISCT et L’IFATS pour valider l’utilisation d’une alternative au FBS., La plupart de ces études examinent la morphologie des ASC, la prolifération, l’immunophénotype et la capacité de ces cellules à se différencier le long de lignées ostéogéniques, chondrogènes et adipogènes dans différents milieux de culture. Peu d’études ont exploré d’autres aspects des ASCs, tels que la sénescence, la stabilité génétique, le transcriptome, le protéome, l’immunogénicité, la sécrétion de cytokines et le cycle cellulaire (Shahdadfar et al., 2005; Bieback et coll., 2012). Alors que les critères ISCT et IFATS étaient une tentative d’unifier le domaine en termes de procédures opérationnelles standard (Dominici et al., 2006; Bourin et coll.,, 2013), il n’existe aucun consensus sur les propriétés des ASCs pertinentes pour les essais cliniques, ce qui rend la comparaison des différents milieux de culture pratiquement impossible. Bien que ces critères fournissent des résultats mesurables pour faciliter la comparaison, la modification des composants utilisés pour l’expansion des ASC peut avoir des effets différents sur l’innocuité, l’efficacité et la reproductibilité des produits finis des ASC. L’examen des changements dans le transcriptome, le protéome et le secretome des ASCs développés dans divers milieux de culture est important, tout comme l’utilisation de cellules développées dans des conditions variables dans des modèles précliniques appropriés.,

le Tableau 1. Les effets des différents suppléments de milieux sur les ASCs in vitro.
les Contributions d’Auteur
CD conçu et rédigé l’examen, et approuvé la version finale du manuscrit. La pm a participé à la conceptualisation de la revue, a révisé et approuvé le manuscrit final. MSP a participé à la conceptualisation de la revue, a édité et approuvé le manuscrit final, et a recueilli le financement des projets concernés. Tous les auteurs ont lu et approuvé le manuscrit final.,
Financement
cette recherche et sa publication sont le résultat d’un financement fourni par le Medical Research Council of South Africa en termes de (A) Flagships Awards Project SAMRC-RFA-UFSP du MRC-01-2013/cellules souches ainsi que (b) L’Unité extra-muros pour la recherche et la thérapie sur les cellules souches. La National Research Foundation of South Africa a également fourni des fonds.
déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière pouvant être interprétée comme un conflit d’intérêts potentiel.,
Remerciements
Les auteurs tiennent à remercier Cheryl Tosh pour son aide rédactionnelle.
Chieregato, K., Castegnaro, S., Madeo, D., Astori, G., Pegoraro, M., et Rodeghiero, F. (2011). Le facteur de croissance épidermique, le facteur de croissance de base des fibroblastes et le facteur de croissance dérivé des plaquettes-bb peuvent remplacer le sérum bovin fœtal et rivaliser avec le plasma riche en plaquettes humain dans l’expansion ex vivo des cellules stromales mésenchymateuses dérivées du tissu adipeux. Cytothérapie 13, 933-943. doi: 10.3109 / 14653249.2011.,583232
PubMed Abstract | CrossRef Texte Intégral | Google Scholar
Mannello, F., et Tonti, G. (2007). Revue Concise: pas de percées pour la culture de cellules souches mésenchymateuses et embryonnaires humaines: milieu conditionné, couche d’alimentation ou sans alimentation; milieu avec sérum de veau fœtal, sérum humain ou plasma enrichi; milieu non conditionné de remplacement de sérum sans sérum ou formule ad hoc? tout ce qui brille n’est pas or! Cellules Souches 25, 1603-1609. doi: 10.1634/cellules souches.2007-0127
PubMed Abstract | CrossRef Texte Intégral | Google Scholar
Selvaggi, T. A., Walker, R. E.,, et Fleisher, T. A. (1997). Développement d’anticorps dirigés contre le sérum fœtal de veau avec des réactions de type arthus chez des patients infectés par le virus de l’immunodéficience humaine recevant des perfusions de lymphocytes syngéniques. Sang 89, 776-779.
PubMed Abstract | Google Scholar
Stedman, T. L. (2006). Dictionnaire médical de Stedman. Philadelphie, PA: Lippincott Williams & Wilkins.
Google Scholar