Comment fonctionne un tampon?
un tampon est capable de résister au changement de pH car les deux composants (acide conjugué et base conjuguée) sont tous deux présents en quantités appréciables à l’équilibre et sont capables de neutraliser de petites quantités d’autres acides et bases (sous forme de H3O+ et OH-) lorsque les sont ajoutés à la solution. Pour clarifier cet effet, nous pouvons considérer l’exemple simple d’un tampon D’acide fluorhydrique (HF) et de fluorure de Sodium (NaF)., L’acide fluorhydrique est un acide faible dû à la forte attraction entre l’ion F relativement petit et les protons solvatés (H3O+), ce qui ne lui permet pas de se dissocier complètement dans l’eau. Par conséquent, si nous obtenons du HF dans une solution aqueuse, nous établissons l’équilibre suivant avec seulement une légère dissociation (Ka(HF) = 6, 6×10-4, favorise fortement les réactifs):
\
on peut alors ajouter et dissoudre du fluorure de sodium dans la solution et mélanger les deux jusqu’à atteindre le volume et le pH souhaités, Lorsque le fluorure de Sodium se dissout dans l’eau, la réaction se termine, ainsi on obtient:
\
puisque Na+ est le conjugué d’une base forte, il n’aura aucun effet sur le pH ou la réactivité du tampon. L’addition de \(NaF\) à la solution augmentera cependant la concentration de F – dans la solution tampon et, par conséquent, selon le principe de Le Chatelier, conduira également à une dissociation légèrement moindre du HF dans l’équilibre précédent. La présence de quantités significatives de l’acide conjugué, \(HF\), et de la base conjuguée, F -, permet à la solution de fonctionner comme tampon., Cette action tampon est visible dans la courbe de titrage d’une solution tampon.
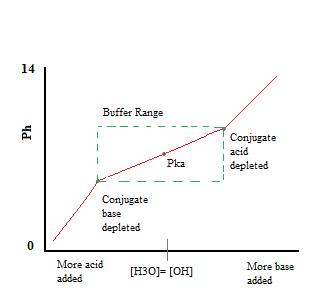
Comme on peut le voir, sur toute l’étendue de la mémoire tampon. le pH change très peu avec l’ajout d’acide ou de base. Une fois que la capacité tampon est dépassée, le taux de changement de pH saute rapidement. Cela se produit parce que l’acide conjugué ou la base a été appauvri par neutralisation. Ce principe implique qu’une plus grande quantité d’acide conjugué ou de base aura une plus grande capacité tampon.,
Si de l’acide était ajouté:
\
dans cette réaction, la base conjuguée, F-, neutralisera L’acide ajouté, H3O+, et cette réaction se terminera, car la réaction de F – avec H3O+ a une constante d’équilibre beaucoup plus grande que un. (En fait, la constante d’équilibre de la réaction telle qu’écrite est juste l’inverse du Ka pour HF: 1/Ka(HF) = 1/(6.6×10-4) = 1.5×10+3.,) Tant qu’il y a plus de F – que de H3O+, presque tout le H3O+ sera consommé et l’équilibre se déplacera vers la droite, augmentant légèrement la concentration de HF et diminuant légèrement la concentration de F-, mais entraînant pratiquement aucun changement dans la quantité de H3O+ présente une fois l’équilibre rétabli.,
Si la base a été ajoutée:
\
dans cette réaction, L’acide conjugué, HF, neutralisera les quantités ajoutées de base, OH-, et l’équilibre se déplacera à nouveau vers la droite, augmentant légèrement la concentration de F – dans la solution et diminuant légèrement la quantité de HF. Encore une fois, puisque la majeure partie de L’OH – est neutralisée, peu de changement de pH se produira.
Ces deux réactions peuvent continuer à alterne avec peu de changement de pH.