Rutherford à Manchester, 1907-1919
Ernest Rutherford a découvert le noyau de l’atome en 1911. Nous lisons cela dans les manuels et dans les écrits populaires. Mais que signifie cette déclaration? La découverte géographique signifie généralement que l’on voit un lieu pour la première fois. Mais la découverte peut-elle être la même pour un royaume caché? On ne peut pas voir un atome dans ce sens., Cela laisse donc entendre que l’histoire de la découverte du noyau était peut-être plus compliquée. L’histoire telle qu’elle se déroulait dans le laboratoire de Rutherford à L’Université de Manchester tournait autour de vraies personnes. Cela impliquait des frustrations et des triomphes. Cela impliquait un travail acharné, de la perplexité et de l’inspiration.
 lorsque Rutherford est devenu professeur à Manchester en 1907, il a trouvé des laboratoires modernes pour l’enseignement et la recherche. À la demande pressante de son prédécesseur, Arthur Schuster, plus de £40,000 ont été levés pour doter le programme de physique. À titre de comparaison, le salaire généreux de Rutherford était de £1 600 / an., Crédit: à Partir du livre: Les laboratoires de physique de l’Université de Manchester: un record de 25 ans de travail par l’Université de Manchester, Manchester: À l’Université de la Presse, 1906. AIP Emilio Segrè Archives visuelles, collection de livres cassants.
lorsque Rutherford est devenu professeur à Manchester en 1907, il a trouvé des laboratoires modernes pour l’enseignement et la recherche. À la demande pressante de son prédécesseur, Arthur Schuster, plus de £40,000 ont été levés pour doter le programme de physique. À titre de comparaison, le salaire généreux de Rutherford était de £1 600 / an., Crédit: à Partir du livre: Les laboratoires de physique de l’Université de Manchester: un record de 25 ans de travail par l’Université de Manchester, Manchester: À l’Université de la Presse, 1906. AIP Emilio Segrè Archives visuelles, collection de livres cassants.
Rutherford arrive à Manchester à L’été 1907, quelques mois avant le début du mandat de l’Université. Il avait été nommé professeur de physique Langworthy, successeur D’Arthur Schuster (1851-1934), qui prit sa retraite à l’âge de 56 ans pour recruter Rutherford. Schuster avait construit un bâtiment de physique moderne, embauché Hans Geiger, Ph. D., (1882-1945) en raison de ses compétences expérimentales, et doté d’un nouveau poste en physique mathématique pour compléter un programme complet de physique. Rutherford est entré au centre du monde de la physique. Les chercheurs sont venus à lui par douzaine.
Rutherford est arrivé avec de nombreuses questions de recherche en tête. Il n’en avait pas fini avec les énigmes des familles de désintégration du thorium, du radium, etc., mais il transmettait une grande partie de ce travail à Boltwood, Hahn et Soddy. Boltwood et Hahn ont tous deux travaillé avec Rutherford à Manchester, Boltwood en 1909-1910 et Hahn en 1907-1908., Rutherford tournait progressivement son attention beaucoup plus vers les rayons α (alpha), β (bêta) et γ (gamma) eux-mêmes et vers ce qu’ils pourraient révéler sur l’atome. Autrement dit, il laissait la radio-chimie aux autres et se tournait vers la physique.
 Rutherford rassemblait toujours un groupe de jeunes chercheurs brillants autour de lui. Dans cette photo de groupe de 1910 sont Ernest Marsden et Hans Geiger. À l’avant et au centre se trouvent les professeurs Schuster et Rutherford, et à L’arrière se trouve William Kay, le talentueux et serviable Intendant de laboratoire. Crédit: J. B. Birks, éd.,, Rutherford à Manchester (Londres: Heywood & Co., 1962), ci-contre p. 38.
Rutherford rassemblait toujours un groupe de jeunes chercheurs brillants autour de lui. Dans cette photo de groupe de 1910 sont Ernest Marsden et Hans Geiger. À l’avant et au centre se trouvent les professeurs Schuster et Rutherford, et à L’arrière se trouve William Kay, le talentueux et serviable Intendant de laboratoire. Crédit: J. B. Birks, éd.,, Rutherford à Manchester (Londres: Heywood & Co., 1962), ci-contre p. 38.
la première équipe de Rutherford à Manchester comprenait Geiger et William Kay (1879-1961), assistant de laboratoire junior depuis 1894. Rutherford a promu Kay au poste d’Intendant de laboratoire en 1908, pour gérer l’équipement de laboratoire et l’aider dans ses recherches. En 1957, Kay a repensé à sa jeunesse avec Rutherford dans une interview. La langue est pittoresque, mais la description est aussi proche de L’approche de Rutherford que nous l’obtenons., Le questionneur était Samuel Devons (1914-2006), qui était l’un des derniers étudiants de Rutherford dans les années 1930.
 Hans Geiger était le principal partenaire de Rutherford dans la recherche sur les rayons alpha de 1907 à 1913. Ensemble, ils ont développé plusieurs façons de détecter les rayons alpha. Ils ont prouvé que les rayons alpha sont des noyaux D’hélium doublement ionisés. CA. 1908. Crédit: AIP Emilio Segre Visual Archives, Physics Today Collection.
Hans Geiger était le principal partenaire de Rutherford dans la recherche sur les rayons alpha de 1907 à 1913. Ensemble, ils ont développé plusieurs façons de détecter les rayons alpha. Ils ont prouvé que les rayons alpha sont des noyaux D’hélium doublement ionisés. CA. 1908. Crédit: AIP Emilio Segre Visual Archives, Physics Today Collection.
Rutherford et Hans Geiger ont travaillé en étroite collaboration en 1907 et 1908 sur la détection et la mesure des particules α., S’ils devaient utiliser des particules α pour sonder l’atome, ils devaient d’abord en savoir plus sur ces particules et leur comportement. Rutherford avait essayé et échoué à McGill pour compter les particules α.
un an plus tard à Manchester, lui et Geiger ont réussi avec deux méthodes d’observation des particules α. La première méthode impliquait des scintillations excitées par des particules α sur une fine couche de sulfure de zinc. Ils les ont observés au microscope et ont compté les scintillations à différents angles de dispersion., Ils ont également développé un « électromètre » qui pourrait démontrer le passage d’une particule α individuelle à un large public. L’instrument, qui a évolué vers le » compteur Geiger », avait un cylindre métallique partiellement évacué avec un fil en son centre. Ils ont appliqué une tension entre le cylindre et le fil suffisamment élevée pour déclencher. Ils ont admis des particules α à travers une mince fenêtre de mica, où ces particules sont entrées en collision avec des gaz, produisant des ions gazeux. Ceux-ci sont ensuite entrés en collision avec d’autres molécules et ont produit plus d’ions, et ainsi de suite., Chaque particule α produit une cascade d’ions qui déchargent partiellement le cylindre et indiquent le passage d’une particule α. Geiger et Rutherford ont publié plusieurs articles en 1908 et 1909 sur ces méthodes et leur utilisation.
Rutherford écrit à Henry Bumstead (1870-1920), un physicien américain, le 11 juillet 1908:
Geiger est un homme bon et travaille comme un esclave. Je n’aurais jamais pu trouver le temps pour la corvée avant que les choses se passent dans le bon style. Enfin tout s’est bien passé, mais la dispersion est le diable. Notre tube fonctionnait comme un charme et nous pouvions facilement obtenir un jet de 50 mm., pour chaque particule. … Geiger est un démon travaillant à compter les scintillations et pouvait compter à intervalles réguliers pendant toute une nuit sans perturber son équanimité. J’ai damné vigoureusement et je me suis retiré après deux minutes. (Cité dans Eve, p. 180.)
bien que Rutherford soupçonnait dès 1906 que les particules α étaient des atomes d’hélium dépouillés de leurs électrons, il exigea un niveau élevé de preuve. Une sorte d’expérience ne suffisait pas. Un type de détecteur ne suffisait pas. Il voulait plus de la preuve., Pour cela, Rutherford souhaitait des « grandes tensions » et de gros électroaimants pour détourner les particules α, mais cette méthode n’était pas encore mûre. L’Intendant de laboratoire William Kay a rappelé dans l’interview d’histoire orale Citée que Rutherford en 1908 a insisté sur le fait que de forts champs électriques et magnétiques étaient nécessaires pour mesurer plus directement la charge et la masse des particules α Et β:
Kay a déclaré que Rutherford voulait un gros aimant refroidi à l’eau, mais qu’il Il avait donc besoin d’une nouvelle ligne d’attaque. La nouvelle ligne était très simple, une procédure chimique mélangée à la physique., Pour ce travail, Rutherford a recruté Thomas Royds (1884-1955), qui avait obtenu son diplôme de physique en 1906. Ils ont recueilli des particules α dans un tube de verre scellé, les ont comprimées et ont fait passer une étincelle électrique à travers. Ils ont étudié la lumière émise dans un spectroscope et l’ont trouvée identique au spectre de l’hélium. Dans quelques mois, Rutherford a reçu le Prix Nobel de Chimie « pour ses recherches sur la désintégration des éléments, et la chimie des substances radioactives., »(Citation Nobel) Rutherford et Royds avaient établi l’identité et les propriétés primaires des particules α. Rutherford tourna ensuite son attention sur leur utilisation pour sonder l’atome.
l’automne 1908 commence une importante série de recherches. Geiger avait fait passer des faisceaux de particules α à travers de l’or et d’autres feuilles métalliques, en utilisant les nouvelles techniques de détection pour mesurer combien ces faisceaux étaient dispersés par les atomes dans les feuilles. Geiger pensait Qu’Ernest Marsden (1889-1970), un étudiant de 19 ans en physique spécialisée, était prêt à aider sur ces expériences et l’a suggéré à Rutherford., Comme Rutherford poussait souvent les étudiants de troisième année dans la recherche, en disant que c’était la meilleure façon d’en apprendre davantage sur la physique, il a facilement accepté.
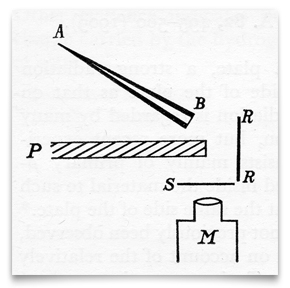 ce croquis, tiré de L’article de 1909 de Geiger et Marsden, montre un tube de verre conique rempli d ‘ « émanation de radium » (radon), fermé à B par une fine vitre de mica. C’était leur source de particules alpha (α). S était un écran de sulfure de zinc, qui scintillait lorsqu’il était frappé par une particule α. P était un écran de plomb, qui empêchait toute particule α de se déplacer directement vers l’écran de sulfure de zinc., RR était une feuille (ou des feuilles) de différents métaux (y compris l’or) qui « réfléchissaient de manière diffuse » les particules α incidentes. Geiger et Marsden ont observé les scintillations résultantes à l’aide d’un microscope d’observation, M. crédit: H. Geiger et E. Marsden, « on a diffus Reflection of the α-Particles », Proceedings of the Royal Society,1909, 82:495-500.
ce croquis, tiré de L’article de 1909 de Geiger et Marsden, montre un tube de verre conique rempli d ‘ « émanation de radium » (radon), fermé à B par une fine vitre de mica. C’était leur source de particules alpha (α). S était un écran de sulfure de zinc, qui scintillait lorsqu’il était frappé par une particule α. P était un écran de plomb, qui empêchait toute particule α de se déplacer directement vers l’écran de sulfure de zinc., RR était une feuille (ou des feuilles) de différents métaux (y compris l’or) qui « réfléchissaient de manière diffuse » les particules α incidentes. Geiger et Marsden ont observé les scintillations résultantes à l’aide d’un microscope d’observation, M. crédit: H. Geiger et E. Marsden, « on a diffus Reflection of the α-Particles », Proceedings of the Royal Society,1909, 82:495-500.
Geiger et Marsden ont commencé par la dispersion à petits angles et ont essayé diverses épaisseurs de feuilles, cherchant des relations mathématiques entre la dispersion et l’épaisseur de la feuille ou le nombre d’atomes traversés., Marsden a rappelé plus tard que Rutherford lui a dit au milieu de ces expériences: « voyez si vous pouvez obtenir un effet des particules alpha directement réfléchies par une surface métallique. »(Rapporté par Marsden dans Birks, 1962, p. 8). Marsden doutait que Rutherford s’attendait à une rétrodiffusion de particules α, mais comme Marsden l’a écrit
it c’était l’une de ces « intuitions » que peut-être un effet pourrait être observé, et que de toute façon le territoire voisin de ce terrain de Tom Tiddler pourrait être exploré par reconnaissance., Rutherford était toujours prêt à faire face à l’inattendu et à l’exploiter, là où c’était favorable, mais il savait aussi quand s’arrêter pour de telles excursions. (Birks, 1962, p. 8)
telle était L’approche ludique de Rutherford dans l’action. Ses étudiants et d’autres ont essayé ses idées, dont beaucoup étaient des impasses. Cette idée de rechercher la rétrodiffusion des particules α a cependant porté ses fruits., Rutherford a écrit:
L’expérience, dirigée par l’imagination disciplinée d’un individu ou, mieux encore, d’un groupe d’individus aux perspectives mentales variées, est capable d’obtenir des résultats qui transcendent de loin la seule imagination du plus grand philosophe. (Cité dans Eve, 1939, Frontmatter)
quelque temps plus tard en 1908 ou 1909, Marsden dit, il a rapporté ses résultats à Rutherford. Rutherford l’a rappelé un peu différemment:
je me souviens …plus tard, Geiger est venu me voir avec une grande excitation et m’a dit: « nous avons pu faire reculer certaines des particules α…, »Ce fut tout à fait l’événement le plus incroyable qui m’est jamais arrivé dans ma vie. C’était presque incroyable comme si vous tiriez une coquille de 15 pouces sur un morceau de papier de soie et qu’elle revenait et vous frappait. (Rutherford, 1938, p. 68)
la mémoire humaine est faillible. Que Marsden ou Geiger ait dit à Rutherford, l’effet était le même. Rutherford a dit qu’ils devraient préparer une publication à partir de cette recherche, qu’ils ont soumis en mai 1909. En outre, cela a commencé Rutherford penser vers ce qui finalement, presque deux ans plus tard, il a publié comme une théorie de l’atome.,
Qu’est-ce que Rutherford a fait pour le reste de 1909 et toute l’année 1910? D’une part, son ami proche Boltwood était à Manchester pour l’année universitaire, travaillant avec Rutherford sur les produits de désintégration radioactive du radium. Il passait également en revue et parlait des idées antérieures sur la structure atomique. Plus important encore, il démontait systématiquement le phénomène de diffusion des particules α et testait chaque pièce. Rutherford n’a pas eu son idée audacieuse — l’atome nucléaire — instantanément, mais il y est venu progressivement en considérant le problème de plusieurs côtés.,
à L’automne 1910, il ramena Marsden à Manchester pour effectuer des tests expérimentaux rigoureux de ses idées avec Geiger. Ils ont rétabli les taux d’émission et les plages de particules α par les sources radioactives et ont réexaminé leurs analyses statistiques. Rutherford a essayé de concilier les résultats de diffusion avec différents modèles atomiques, en particulier celui de J. J. Thomson, dans lequel l’électricité positive était considérée comme dispersée uniformément dans toute la sphère de l’atome.
 une page des premières notes brutes de Rutherford, non datées (1910 ou 1911)., Les premières lignes se lisent: « théorie de la structure de l’atome. Supposons que l’atome se compose de + charge ne au centre & de – charge comme électron distribué dans toute la sphère de rayon R. » Il a ensuite ébauché des idées sur le calcul de la force de déviation sur une particule chargée passant près de ce centre chargé. Crédit: J. B. Birks, éd., Rutherford à Manchester (Londres: Heywood & Co. De 1962), p. 70.
une page des premières notes brutes de Rutherford, non datées (1910 ou 1911)., Les premières lignes se lisent: « théorie de la structure de l’atome. Supposons que l’atome se compose de + charge ne au centre & de – charge comme électron distribué dans toute la sphère de rayon R. » Il a ensuite ébauché des idées sur le calcul de la force de déviation sur une particule chargée passant près de ce centre chargé. Crédit: J. B. Birks, éd., Rutherford à Manchester (Londres: Heywood & Co. De 1962), p. 70.
à un moment donné de l’hiver 1910-1911, Rutherford a élaboré l’idée de base d’un atome avec un « centre chargé., »Comme Geiger et Marsden l’ont souligné dans leur article de 1909:
Si l’on tient compte de la vitesse et de la masse élevées de la particule α, il semble surprenant que certaines des particules α, comme le montre l’expérience, puissent être tournées dans une couche de 6 x 10-5 cm. d’or à travers un angle de 90°, et même plus. Pour produire un effet similaire par un champ magnétique, l’énorme champ de 109 unités absolues serait nécessaire. (Birks, p., 179)
Rutherford a conclu dans son article de mai 1911 qu’un écart aussi remarquable dans la trajectoire d’une particule chargée massive ne pouvait être atteint que si la majeure partie de la masse, disons, d’un atome d’or et la majeure partie de sa charge étaient concentrées dans un très petit corps central. Note: à ce stade en 1911, Rutherford n’a pas appelé cela un « noyau. »
Vous devez installer Flash Player pour écouter ce clip audio.,
la première annonce publique de la théorie nucléaire par Rutherford a été faite lors d’une réunion de la Manchester Literary and Philosophical Society, et il nous a invités jeunes garçons à aller à la réunion. Il a dit qu’il avait des choses intéressantes à dire et qu’il pensait qu’on aimerait les entendre. Nous ne savions pas de quoi il s’agissait à l’époque. Les personnes âgées du laboratoire l’ont fait, bien sûr Geiger et Marsden le savaient parce qu’ils faisaient déjà les expériences. En fait, à moins d’en avoir fait quelques-uns qui étaient suffisants pour être décisifs, Rutherford ne l’a jamais mentionné publiquement., Et, bien sûr, Darwin le savait beaucoup plus tôt. Mais cela devait être au début de 1911, et nous sommes allés à la réunion et il nous a dit. Et il a mentionné alors qu’il y avait des preuves expérimentales qui avaient été obtenues par Geiger et Marsden. Pour autant que je me souvienne, il n’en a pas dit plus sur les résultats que sur le fait qu’ils étaient assez décisifs. Et, comme je l’ai dit avant, il n’aurait jamais fait une annonce publique de ce genre, s’il n’avait pas eu de bonnes preuves., Et c’est l’une des caractéristiques qui traverse tout le travail de Rutherford, en particulier tout son travail jusqu’à la fin de la période de Manchester. Si vous regardez certains de ses articles dans les premiers jours, j’appelle McGill les premiers jours, il était tout à fait convaincu que les particules alpha ont été atomes d’hélium, mais il n’a jamais dit que, dans ces mots. Il a toujours dit qu’il s’agissait soit d’atomes d’hélium, soit de molécules d’hydrogène, ou peut-être a-t-il dit autre chose de ce poids., Il était tout à fait caractéristique de lui qu « il ne dirait jamais une chose était si à moins qu » il avait des preuves expérimentales pour cela qui le satisfaisait vraiment.
En fait, Rutherford a été extrêmement prudent en tirant des conclusions sur cette charge centrale: « un simple calcul montre que l’atome doit être le siège d’un champ électrique intense afin de produire une déflexion aussi importante lors d’une seule rencontre. »(Birks, p. 183). Il a élaboré rapidement et grossièrement que plusieurs relations quantitatives devraient être vraies si cette théorie de base était correcte., Tout d’abord, le nombre de particules α dispersées à travers un angle donné doit être proportionnel à l’épaisseur de la feuille. Deuxièmement, ce nombre devrait être proportionnel au carré de la charge nucléaire. Enfin, il devrait être inversement proportionnel à la quatrième puissance de la vitesse de la particule α. Ces trois idées ont défini le programme expérimental de Geiger et Marsden pour l’année prochaine.
Vous devez installer Flash Player pour écouter ce clip audio.,
Rutherford s’intéressait alors presque entièrement à la recherche. Il avait très peu enseigné à McGill. Il était professeur de recherche. Je suppose qu’il a donné quelques conférences, mais cela aurait été très peu. Et son intérêt était tout naturellement du côté de la recherche. Il a donné quelques conférences, mais des conférences élémentaires, le genre de chose qu’on s’attendrait à ce qu’un homme sache avant de venir à l’Université. Ils étaient les conférences aux ingénieurs. Ils étaient un lot tapageur et Rutherford pouvait les garder sous contrôle., Il y avait peut-être un seul autre homme dans le département qui aurait pu le faire, et il (Rutherford?) les a appréciés parce qu’il a pu leur montrer les expériences très intéressantes que l’on peut effectuer dans les cours élémentaires.
On m’a souvent dit que Rutherford était un mauvais conférencier. Je n’ai jamais entendu de telles bêtises. Il est vrai qu’à l’occasion, il serait un peu terne, un peu mélangé, mais ce ne fut qu’en de très rares occasions. Il y avait d’autres occasions où il était vraiment le plus stimulant. Il y avait un enthousiasme énorme à son sujet.,
Rutherford a évoqué la possibilité que le centre chargé soit négatif. Cela semble étrange aujourd’hui, alors qu’est-ce qui l’a rendu raisonnable? Premièrement, il n’était pas très différent du modèle de Thomson. Deuxièmement, puisque Rutherford savait que les particules α portent une charge double+, il pensait que cela pourrait agir de la même manière que le soleil sur une comète balayant près d’elle. Il lancerait la particule α autour et en arrière vers sa source. Il a également considéré un modèle presque oublié suggéré par le physicien Japonais Hantaro Nagaoka (1865-1950) — le modèle saturnien., Nagaoka et Rutherford étaient en contact en 1910 et 1911 et Rutherford a mentionné le modèle de Nagaoka d ‘ « une masse centrale attractive entourée d’anneaux d’électrons en rotation » (Birks, p. 203). Le résultat final dans cet article critique de Rutherford, cependant, était L’annonce de Rutherford que si l’atome était un disque ou une sphère, et même si la charge centrale était positive ou négative, n’affecterait pas les calculs. Rutherford a toujours pris soin de ne pas réclamer plus que ses résultats ne pouvaient le soutenir.,
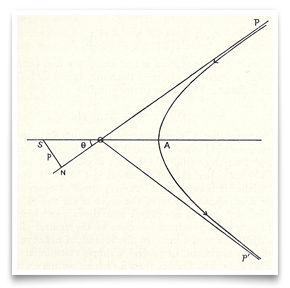 dans le désormais célèbre article de Rutherford de mai 1911 sur la diffusion des particules alpha par feuille d’Or, il a inclus cette esquisse du chemin hyperbolique d’une particule. Crédit: E. Rutherford, « La Diffusion de α et β des Particules de la Matière et de la Structure de la Matière », Revue Philosophique, 1911, 21:669-688.
dans le désormais célèbre article de Rutherford de mai 1911 sur la diffusion des particules alpha par feuille d’Or, il a inclus cette esquisse du chemin hyperbolique d’une particule. Crédit: E. Rutherford, « La Diffusion de α et β des Particules de la Matière et de la Structure de la Matière », Revue Philosophique, 1911, 21:669-688.
Rutherford a vu des tests possibles de la nature de la charge centrale. L’absorption des particules β, a-t-il dit, devrait être différente avec un centre négatif par rapport à un centre positif., Un centre positif expliquerait la grande vitesse que les particules α atteignent lors de l’émission d’éléments radioactifs. Mais ce n’étaient que des indications.
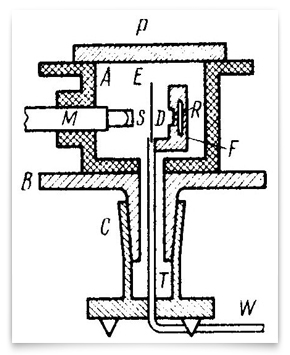 ce schéma représente les expériences raffinées de 1912-1913 entreprises par Geiger et Marsden. R était la source de particules alpha, E était la feuille d’or, et M était le microscope rotatif autour d’un axe vertical centré sur la feuille d’or. Les particules Alpha de la source ont traversé le diaphragme D, ont été dispersées par la feuille et ont été observées sous forme de scintillations sur L’écran S., Geiger et Marsden ont observé les angles des particules dispersées en faisant tourner l’ensemble microscope-écran. Crédit: H. Geiger et E. Marsden, « les Lois de La Flexion des Particules alpha par de Grands Angles,” Revue Philosophique, 1913, 25:604-623.
ce schéma représente les expériences raffinées de 1912-1913 entreprises par Geiger et Marsden. R était la source de particules alpha, E était la feuille d’or, et M était le microscope rotatif autour d’un axe vertical centré sur la feuille d’or. Les particules Alpha de la source ont traversé le diaphragme D, ont été dispersées par la feuille et ont été observées sous forme de scintillations sur L’écran S., Geiger et Marsden ont observé les angles des particules dispersées en faisant tourner l’ensemble microscope-écran. Crédit: H. Geiger et E. Marsden, « les Lois de La Flexion des Particules alpha par de Grands Angles,” Revue Philosophique, 1913, 25:604-623.
Geiger et Marsden ont effectivement travaillé systématiquement à travers les implications testables de L’hypothèse de charge centrale de Rutherford. La première grande publication de leurs résultats fut en allemand dans les actes de L’Académie des Sciences de Vienne (Sitzungberichte der Wiener Akademie der Wissenschaften) en 1912., Cette version de 30 pages a été suivie d’une version en anglais en 1913 dans la Revue Philosophique: « the Laws of Deflexion of α Particles through Large Angles » la version anglaise est la plus connue. De légères différences entre les deux ont conduit un historien à suggérer que Rutherford a décidé en faveur d’un centre chargé positivement en août 1912 (Trenn, 1974). Les autres membres de l’équipe de Rutherford, en particulier Charles Galton Darwin (1887-1962), H. G. J. Moseley (1887-1915) et Niels Bohr (1885-1962) ont joué un rôle important dans l’établissement ultime de L’atome nucléaire de Rutherford.,
 Le jeune Henry G. J. Moseley, dans le Bailleul-Trinité de Laboratoire, Oxford, ca. 1910. Plus tard cette année-là, Moseley a commencé des recherches dans le Laboratoire de Rutherford à Manchester. Sa brillante carrière a été écourtée au combat pendant la Première Guerre mondiale.crédit: Université D’Oxford, Musée de l’histoire des Sciences, avec la permission de AIP Emilio Segrè Visual Archives, Physics Today Collection.
Le jeune Henry G. J. Moseley, dans le Bailleul-Trinité de Laboratoire, Oxford, ca. 1910. Plus tard cette année-là, Moseley a commencé des recherches dans le Laboratoire de Rutherford à Manchester. Sa brillante carrière a été écourtée au combat pendant la Première Guerre mondiale.crédit: Université D’Oxford, Musée de l’histoire des Sciences, avec la permission de AIP Emilio Segrè Visual Archives, Physics Today Collection.
La « Grande Guerre » a totalement perturbé le travail dans le Département de Manchester de Rutherford. Bohr retourna au Danemark. Marsden a accepté un poste de professeur en Nouvelle-Zélande. Moseley est mort à la bataille de Gallipoli., James Chadwick (1891-1974), qui travaillait avec Geiger à L’Université technique de Berlin lorsque la guerre a éclaté, a passé plusieurs années interné dans le camp de prisonniers de guerre de Ruhleben. D’autres étudiants sont également partis à la guerre, et Rutherford a consacré une énergie considérable à mobiliser la science pour l’effort de guerre et plus particulièrement aux techniques anti-sous-marines.
 Niels Bohr a d’abord travaillé avec Rutherford à
Niels Bohr a d’abord travaillé avec Rutherford à
Manchester en 1912. Cette photo montre les jeunes Niels et Margrethe Bohr, ca., 1914, quand Bohr a succédé à Charles Galton Darwin comme le lecteur Schuster en Physique mathématique à Manchester. Crédit: AIP Emilio Segre Visual Archives, Collection Margrethe Bohr.
dans ce contexte distrait, Rutherford et son intendant de laboratoire, William Kay, ont commencé en 1917 à explorer le passage des particules α à travers l’hydrogène, l’azote et d’autres gaz. Lorsque la Grande Guerre a pris fin, Ernest Marsden a brièvement aidé avec les fastidieuses observations de scintillation qui ont fourni des indices sur la nature du noyau. Rutherford a rapporté les résultats provisoires de ces expériences étendues en 1919., Rutherford a placé une source de radium C (bismuth-214) dans un récipient en laiton scellable, monté de manière à ce que la position de la source puisse être modifiée et à ce que différents gaz puissent être introduits ou un vide produit, selon le désir. Les particules α ont traversé l’intérieur du récipient et ont traversé une fente, recouverte d’une plaque d’argent ou d’un autre matériau, et ont frappé un écran de sulfure de zinc, où une scintillation a été observée dans une pièce sombre. Lorsque de l’hydrogène gazeux a été introduit dans le récipient et que l’on a pris soin d’absorber les particules α Avant qu’elles ne touchent l’écran, des scintillations ont encore été observées., Rutherford a postulé que lorsque les particules α traversaient le gaz hydrogène, elles entraient parfois en collision avec des noyaux d’hydrogène. Comme Rutherford l’a écrit, cela a produit des « atomes d’hydrogène rapides » qui ont été principalement projetés vers l’avant dans la direction du mouvement original des particules α.
Rutherford avait plusieurs questions subtiles en tête au cours de ces expériences, principalement concernées par la nature du noyau., Il a demandé à son collègue Darwin d’analyser ces collisions sur la base d’une « théorie simple » de collisions élastiques entre des noyaux ponctuels repoussés selon une loi carrée inverse, les particules α portant une charge de 2 fois celle d’un électron (et de signe opposé) et les noyaux d’hydrogène 1 fois. Darwin a constaté que toutes les particules α approchant à moins de 2. 4×10-13 cm produiraient un » atome d’hydrogène rapide.’ Cette théorie simple, cependant, prédit beaucoup moins d’atomes d’hydrogène accélérés que ce qui a été observé dans les expériences.,
Rutherford a rejeté les explications de cette variance basées sur des charges différentes sur les particules ou d’autres lois que les lois carrées inverses. Plutôt, il a conclu que pour des distances de l’ordre du diamètre de l’électron, ‘la structure du noyau d’hélium ne peut plus être considéré comme un point…’. Il a postulé que le noyau d’hélium (particule α) a une structure complexe de quatre noyaux d’hydrogène plus deux électrons chargés négativement. (Nous dirions qu’il est composé de deux protons.,) Rutherford a conclu que la déformation des noyaux complexes lors des collisions était une explication plus probable, la variation des forces entre les noyaux variant de manière complexe en approche rapprochée.
compte tenu des forces intenses mises en jeu dans de telles collisions, il ne serait pas surprenant que le noyau d’hélium se brise. Aucune preuve d’une telle désintégration…a été observée, indiquant que le noyau d’hélium doit être une structure très stable.,
nous devons nous rappeler que Rutherford ne pouvait pas observer directement la structure du noyau, ses conclusions étaient donc provisoires. Néanmoins, il envisageait ouvertement les possibilités d’un noyau complexe, capable de déformation et même de désintégration possible. Ces pensées ont façonné cette période intense de recherches expérimentales.