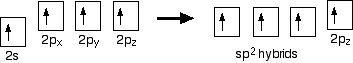Un simple point de vue de doubles liaisons covalentes
Une double liaison covalente est là que deux paires d’électrons sont partagés entre les atomes, plutôt que juste une paire.
certaines molécules simples contenant des doubles liaisons
oxygène, O2
deux atomes d’oxygène peuvent tous deux obtenir des structures stables en partageant deux paires d’électrons comme dans le diagramme.
La double liaison est montré de façon conventionnelle par deux lignes joignant les atomes. Chaque ligne représente une paire d’électrons partagés.,
le dioxyde de Carbone, CO2
l’Éthène, C2H4
Éthylène a une double liaison entre deux atomes de carbone.
Une vision plus sophistiquée de la liaison dans l’éthène
Il est important d’explorer la liaison dans l’éthène, plus en détail, car elle a un impact direct sur sa chimie. À moins d’avoir une certaine compréhension de la vraie nature du double lien, vous ne pouvez pas vraiment comprendre la façon dont ethene se comporte.,
Une orbitale vue de la liaison dans l’éthène
l’Éthène est construit à partir des atomes d’hydrogène (1s1) et des atomes de carbone (1s22s22px12py1).
Promotion d’un électron
L’atome de carbone n’a pas assez d’électrons non appariés pour former le nombre requis de liaisons, il doit donc promouvoir l’une des paires 2s2 dans l’orbitale 2PZ vide. C’est exactement la même chose que lorsque le carbone Forme des liaisons – tout ce à quoi il finit par se joindre.
L’atome de carbone est maintenant dans un état excité.,
hybridation
dans le cas de l’éthène, il y a une différence avec le méthane car chaque carbone ne se joint qu’à trois autres atomes plutôt qu’à quatre. Lorsque les atomes de carbone hybrident leurs orbitales externes avant de former des liaisons, cette fois, ils n’hybrident que trois des orbitales plutôt que les quatre. Ils utilisent l’électron 2s et deux des électrons 2p, mais laissent l’autre électron 2P inchangé.