Introduction
la compréhension et la gestion des relations V/Q représentent une pierre angulaire de la gestion des patients en unité de soins intensifs (USI). TheV/Q relation (Fig. 1) peut être considéré comme un spectre entreadspace (infini V/Q) et shunt (zéro V/Q).
lorsque le sang pulmonaire est exposé à une pression partielle alvéolaire d’oxygène (PAO2), les molécules d’oxygène se déplacent dans le plasma sous forme d’O2 dissous et continuent d’exercer une pression partielle.,
la plupart de ces molécules d’oxygène se combinent immédiatement avecl’hémoglobine et entrent dans un État dans lequel elles n’exercent plus directementune pression partielle. Ce processus se poursuit jusqu’à ce qu’une pression partiellegradient entre l’Alvéole et le plasma n’existe plus, à quel point l’hémoglobine est saturée au maximum pour le sangpo2.
même si l’oxygène dissous dans le plasma ne représente que 1,5% à 3% de l’oxygène total dans le sang, la valeur po2 est importante car elle détermine la force d’entraînement pour le mouvement de l’oxygène Dans et hors du sang.,
un échange parfait de gaz de sang nécessiterait que chaque alvéole soit ventilée parfaitement et que tout le sang soit éjecté du ventricule droit pour éviter les capillaires pulmonaires complètement fonctionnels. De plus, la diffusion à travers la membrane alvéolaire/capillaire devrait être entravée.
parce que tout le sang passant du ventricule droit au ventricule gauche atteindrait un équilibre parfait avec les alvéolargas, le po2 alvéolaire (PAO2) et le po2 artériel (PaO2) seraient identiques.
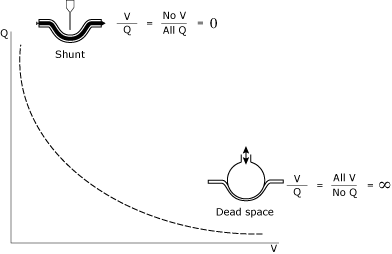
FIG. 1., L’illustration mathématique et conceptuelle de shunt et deadspace.
comme représenté sur la Fig. 2, oxygénation dans les poumons normaux maydiffer de la situation idéale parce que la distribution de perfusionis inégale.
relativement plus de flux sanguin se produit dans les zones dépendantes de la gravité, et un certain drainage veineux (des veines bronchique, pleurale et Thébésienne) se vide directement dans le côté gauche du cœur, contournant ainsi (shunting) le mécanisme normaloxygénation .,
pour cette raison, un peu de sang pénètre dans le ventricule gauche avec une teneur en oxygène inférieure à celle du sangéchanger avec une Alvéole idéale. La Figure 3 représente le niveau de PaO2 inférieur à la concentration par rapport à la tension d’oxygène idéale calculée.
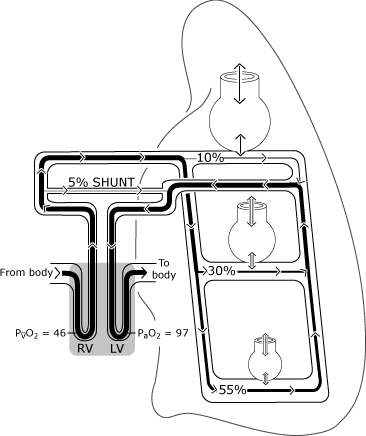
FIG. 2. Le poumon normal a une distribution imparfaite de la ventilation et de la perfusion qui est principalement déterminée par la gravité. L’illustration suppose une posture verticale de sorte que les bases pulmonaires soient dans la position dépendante de la gravité., Les alvéoles non dépendantes de la gravité sont plus grandes, mais reçoivent moins d’échange de gaz (ventilation) que les alvéoles dépendantes de la gravité. La Distribution de la perfusion est principalement régie par la gravité, environ 55% s’écoulant vers les zones dépendantes de la gravité, 30% vers les zones pulmonaires médianes et 10% vers les zones pulmonaires non dépendantes de la gravité. PaO2 et PvO2 sont exprimés en mmHg (kPa = mmHg × 0,133); RV = ventricule droit; LV = ventricule gauche. Reproduit avec l’autorisation D’Elsevier Health Sciences.
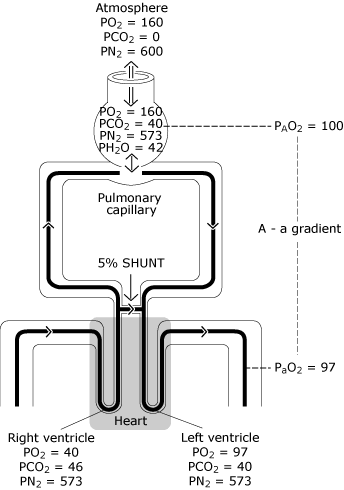
FIG. 3., Le poumon normal a une distribution imparfaite de la ventilation, une distribution imparfaite de la perfusion et un degré minimal de shunt intrapulmonaire. Le résultat est une diminution de PO2 de la valeur alvéolaire idéale calculée (PAO2) à la valeur artérielle systémique mesurée (PaO2). Cette différence de PO2 est connue sous le nom de « gradient de tension de l’oxygène alvéolaire à artériel ». PO2 = tension d’oxygène exprimée en mmHg; PCO2 = tension de dioxyde de carbone exprimée en mmHg; PN2 = tension d’azote exprimée en mmHg; PH2O = tension de vapeur d’eau exprimée en mmHg. (kPa = mmHg × 0,133)., Reproduit avec l’autorisation D’Elsevier Health Sciences.
Shunt et hypoxémie
le shunt anatomique est défini comme le sang qui va du côté droit vers le côté gauche du cœur sans traverser les capillaires pulmonaires. Le shunt capillaire est défini comme le sang qui va dele côté droit du cœur au côté gauche du cœur viapulmonaire capillaires qui sont adjacents aux alvéoles non ventilées.
Les deux cas permettent au sang d’entrer dans la circulation du côté gauche sansune augmentation de la teneur en oxygène., Ceci est appelé zéro V / Q, oule shunt vrai, parce que le sang n’a eu aucune possibilité d’échange de gaz avec des alvéoles fonctionnelles.
un exemple de shunt dans le cadre clinique est les anomalies d’échange gazeux observées dans la pneumonie par la libération d’endotoxine qui conduit à l’œdème cellulaire et à la vasoconstriction .
shunt et hypoxémie ne sont pas des termes synonymes, pas plus qu’ils n’ont des relations linéaires. L’effet hypoxémique de tout shunt dépendra non seulement de la taille du shunt, mais aussi de l’oxygénationstat du sang veineux qui shunte(SVO2)., Un petit shunt avec un faible VO2 peut avoir des effets hypoxémiques profonds, tandis qu’un grand shunt avec un SvO2 élevé causera une hypoxémie moins significative.
on peut affirmer sans équivoque qu’en cas d’hypoxémie, un certain degré de shunt (intrapulmonaire ou intracardiaque) doit êtreprésent; cependant, l’effet du shunt sur lepao2 dépend grandement de la fonction cardiovasculaire et du taux métabolique. L’hypoxémie artérielle est le résultat de lungfonction, fonction cardiovasculaire et métabolisme.,
L’évaluation des poumons en tant qu’oxygénateur est essentielle dans les soins de nombreux patients nécessitant des soins de soutien cardiopulmonaire. Le calcul de la dérivation intra-pulmonaire représente le meilleur moyen disponible de déterminer dans quelle mesure le système pulmonaire contribue àl’hypoxémie.
shunt intrapulmonaire
comme indiqué précédemment, le shunt intrapulmonaire est défini comme thatportion du débit cardiaque entrant dans le côté gauche du coeur sans subir d’échange de gaz parfait avec des alvéoles complètement fonctionnelles. Le shunt intrapulmonaire peut être divisé en troiscomposants.,
- la dérivation anatomique a déjà été décrite comme du sang qui pénètre dans le côté gauche du cœur sans traverser les capillaires pulmonaires. En plus du shunt anatomique normal des veines bronchiques, pleurales et Thébésiennes, le shunt anatomique peut être augmenté par des tumeurs pulmonaires vasculaires et des shunts intracardiaques de droite à gauche.
- le shunt capillaire est causé lorsque le sang traverse les capillaires pulmonaires mais ne s’équilibre pas avec le gaz alvéolaire en raison de processus pathologiques tels que l’atélectasie, la pneumonie et les lésions pulmonaires aiguës.,
- Le mélange veineux se produit lorsque le sang s’équilibre avec un PO2 alvéolaire qui est moins qu’idéal comme dans les situations de faible V / Q. Parce que le mélange veineux n’est pas vrai shunt, cela conduit parfois à la confusion. La somme des shunts anatomiques et capillaires est le plus souvent appelée zéro V/Q ou shunt vrai. Le mélange veineux est souvent appelé faible V / Q ou”effet shunt ». Le shunt physiologique dans les poumons normaux ou non malades est une mesure du shunt intrapulmonaire normal. Dans le cadre de la pathologie pulmonaire, le shunt physiologique représente principalement la gravité de l’état de la maladie.,
l’équation de shunt
l’équation utilisée pour calculer la portion de shunt du débit cardiaque suppose que le gaz non shunt s’oxygène parfaitement par échange avec un gaz alvéolaire parfait.
bien que le concept de shunt intra-pulmonaire ne reflète pas les relations régionales, tout comme le concept de perfusion de ventilation, il reflète le degré auquel le poumon s’écarte de l’idéal d’anoxygénateur du sang pulmonaire.
c’est cette capacité quantitative à regarder les poumons comme un oxygénateur qui rend cette mesure unique et précieuse dans le cadre clinique., Cette revue utilise le shunt physiologique de theterm en référence au shunt intrapulmonaire calculé avec le patient respirant moins de 100% d’oxygène.
la dérivation de l’équation de shunt provient des concepts ofFick. En 1870, il introduit la relation classique selon laquelle la quantité d’oxygène disponible pour l’utilisation tissulaire par unité de temps comprend la teneur en oxygène artériel (Cao 2)multipliée par la quantité de sang artériel présentée aux tissus par unité de temps (débit cardiaque, Qt).,
l’Équation 1:
l’Oxygène disponible =(Qt)(CaO2)
l’Oxygène retourné vers les poumons comprend le débit cardiaque(Qt) multiplié par le veineux mêlé en oxygène contenu(CVO2).
équation 2:
oxygène retourné =(Qt)(CvO2)
La consommation D’oxygène par unité de temps (VO2) devrait refléter l’oxygène qui a été extrait du sang pendant cette période.,
l’Équation 3:
VO2 = (Qt)(CaO2)– (Qt)(CvO2)
l’Équation 3 peut alors être réécrite comme ce qui est classicallydescribed que l’Équation de Fick.
équation 4:
VO2 = Qt(CaO2 –CvO2)
réarrangée algébriquement, L’équation 4 peut être exprimée comme une fonction du débit cardiaque.,
équation 5:
Qt = VO2/(CaO2 –CvO2)(10)
pour exprimer le débit cardiaque en litres par minute, la différence d’oxygénation doit être
multipliée par un facteur de 10.
deux autres équations avec lesquelles il faut se familiariser sont l’équation de shunt classique (équation 6), qui décrit le rapport entre le débit cardiaque shunté et le débit cardiaque total(QS / Qt). Il est mesuré avec le patientpersonner 100% d’oxygène.,
équation 6:
QS/Qt = (CcO2 –CaO2)/(Cco2 –CvO2)
l’équation de dérivation physiologique (QSP / Qt) est une autre façon d’exprimer L’équation 6 lorsqu’elle est mesurée avec le patient 100% d’oxygène et un mélange veineux existe.Par conséquent, l’équation de shunt physiologique est:
équation 7:
QSP/Qt = (CcO2 –CaO2)/ (Cco2 –CvO2)
Le QSP/Qt a l’avantage d’être considéré comme un rapport de sorte qu’aucune mesure absolue de le débit cardiaque est nécessaire., Sous cette forme, l’équation démontre clairement que commele débit cardiaque shunté approche de zéro, le contenu en oxygène artériel doit s’approcher de la teneur en oxygène pulmonaire terminale théorique.
tant qu’une partie du débit cardiaque ne s’échange pas parfaitement avec des alvéoles parfaites, le contenu en oxygène artériel doit être inférieur au contenu en oxygène capillaire pulmonaire idéal.
Les implications de l’équation de shunt physiologique peuvent êtreconceptualisée en considérant les termes de teneur en oxygène(CcO2, CaO2,CvO2) comme des entités qui peuvent être versées dans un conteneur (Fig. 4)., Certains facteurs, tels que l’hémoglobineconcentration, peuvent affecter les trois niveaux.
la variable clinique la plus importante affectant le CcO2 estfio2, alors que le débit cardiaque total et la consommation d’oxygène affectent le CvO2. Les changements dans le shunt physiologique affectent Cao 2.
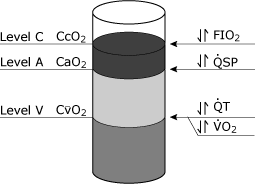
FIG. 4. Représentation schématique des niveaux d’oxygène dans le sang qui pourraient théoriquement être obtenus à partir de trois sites distincts dans le système cardiovasculaire. Le niveau C représente la teneur en oxygène du sang capillaire pulmonaire d’extrémité (CcO2)., Le niveau A représente la teneur en oxygène du sang artériel systémique (CaO2) et le niveau V représente la teneur en oxygène du sang veineux mixte (artère pulmonaire) (CvO2). Les variables cliniques les plus courantes qui affectent spécifiquement ces différents niveaux sont indiquées: le niveau C est le plus souvent affecté par les changements de FIO2 (fraction d’oxygène inspirée), le niveau A est spécifiquement affecté par les changements du shunt physiologique (QSP), le niveau V est spécifiquement affecté à la fois par le débit cardiaque total (QT) et le taux Reproduit avec l’autorisation D’Elsevier Health Sciences.,
le numérateur de l’équation de shunt est représenté pardifférences dans CcO2 etcao2. Le dénominateur de l’équation estreprésenté par les différences de CcO2 etcvo2.
des changements de magnitude inégale entre ces trois niveaux modifieront le rapport, ce qui équivaut à des changements dans le calcul du shunt physiologique.
Si un patient développe une consolidation mineure du lobe droit, du lobe moyen et du lobe inférieur, Les mesures des gaz sanguins de l’artère artérielle et de l’artère pulmonaire révéleraient une image aclinique telle que reflétée à la Fig. 5.,
l’oxygénation artérielle et le contenu sont significativement diminués en raison d’un grand shunt intrapulmonaire. Si le débit cardiaque reste inchangé etla différence d’oxygène veineux artério-mixte ne change pas, alorsle CvO2 doit également diminuer.
en raison du changement d’ampleur inégale, le shunt physiologique augmentera considérablement secondaire à l’hypoxémie.
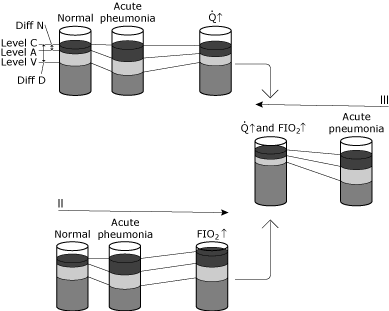
FIG. 5. Représentation schématique des changements dans les niveaux d’oxygène dans le sang dans diverses conditions., Le but de cette illustration est de conceptualiser la différence entre le shunt physiologique et l’effet hypoxémique du shunt physiologique. I, II et III illustrent les changements chez une personne normale qui contracte une pneumonie qui provoque une augmentation significative du shunt intrapulmonaire sans aucun changement physiologique compensatoire., Le statut de la pneumonie normale à la pneumonie aiguë montre: aucun changement du niveau C parce que la ventilation et FIO2 sont inchangées, une baisse spécifique du niveau A en raison de l’augmentation du shunt créé par la pneumonie, et une baisse du niveau V parce que la différence de teneur en AV est inchangée (débit cardiaque et consommation d’oxygène inchangés). Étant donné que Diff N a augmenté à un degré plus élevé que Diff D, le shunt calculé augmente. Condition 1 montre une augmentation du débit cardiaque (Q↑) en réponse à l’hypoxémie aiguë. Le niveau C reste inchangé puisque ni la ventilation ni le FIO2 n’ont été modifiés., La différence de teneur en AV s’est réduite car le débit cardiaque a augmenté, tandis que la consommation d’oxygène reste inchangée. L’augmentation du niveau V entraîne un nouvel équilibre dynamique dans lequel le niveau A est également augmenté. Notez que la relation entre Diff N et Diff D n’est que légèrement modifiée. Ainsi, le niveau A (et donc le PaO2) a augmenté avec peu de changement dans le shunt calculé. Dans ce cas, la compensation de l’hypoxémie est cardiovasculaire; le shunt intrapulmonaire n’a pas changé. La Condition II montre une augmentation de la concentration en oxygène inspiré (FIO2↑)., Le niveau C augmente, tandis que la différence de teneur en AV reste inchangée (débit cardiaque et consommation d’oxygène inchangés). Un nouvel équilibre dynamique entraîne le niveau A (et donc l’augmentation du PaO2). La relation entre Diff N et Diff D n’est que légèrement modifiée. Le niveau A (et donc PaO2) a augmenté avec peu de changement dans le shunt calculé. Dans ce cas, la compensation de l’hypoxémie se fait par oxygénothérapie; le shunt intrapulmonaire est essentiellement inchangé. La Condition III montre à la fois le débit cardiaque et les changements de concentration en oxygène inspiré (Q↑ et FIO2 Fi)., Notez l’augmentation profonde du niveau A (et donc de la PaO2) avec peu de modifications dans le Diff N/Diff D. reproduit avec la permission D’Elsevier Health Sciences.
une hypoxémie sévère entraînera généralement une augmentation de la sortie cardiaque. Il en résulte une diminution de la différence de teneur en oxygène artériel-veineux telle que reflétée par une augmentation inCvO2.
un nouvel équilibre entraînera une augmentation de CAO 2 sans changement de rapport(QSP / Qt). Le po2 artériel S’améliore considérablement, sans changement significatif des shuntsecondary physiologiques, dus à un débit cardiaque amélioré.,
Si l’on suppose qu’un supplément d’oxygène est administré à ce patient alors que le débit cardiaque reste interrompu, le CcO2 est augmenté en second lieu à l’augmentation du PO2 alvéolaire. Étant donné que le shunter physiologique reste le même et que la différence de teneur en oxygène artério-veineux reste la même, un nouvel équilibre entraîne une augmentation de l’inCaO2 et du Cvo2.
enfin, les circonstances sont modifiées pour représenter un patient avecun traitement à l’oxygène et une augmentation du débit cardiaque.CaO2 augmente parce que les deux CO2 et CvO2 augmentent.L’hypoxémie s’améliore tandis que le rapport (QSP/QT)reste inchangé.,
le calcul du shunt physiologique peut refléter de manière fiable le degré d’échange gazeux attribuable à une maladie intrapulmonaire ou à un shunt intracardiaque, indépendamment d’autres facteurs qui peuvent également jouer un rôle.
étant donné que de multiples causes d’hypoxémie sont fréquemment dénombrées chez les personnes gravement malades, la capacité de quantifier le degré de physiopathologie intrapulmonaire est un outil extrêmement important.
comment déterminer le shunt
le shunt intrapulmonaire ne peut être mesuré que lorsque les deux échantillons de sang artériel et pulmonaire sont disponibles et que le FIO2 est constant., Cathéters insertedinto la circulation veineuse centrale qui se trouvent juste au-dessus de thesuperior veine cave-jonction auriculaire droite sont largement insuffisants forshunt déterminations parce que le sang prélevé à partir de cette position willnot contenir le sang significativement désaturé de la coronarysinus ou veine cave inférieure.
Les échantillons de sang prélevés dans l’oreillette droite présentent une variation significative de la teneur en oxygène en raison de la dérivation du flux sanguin et du mouvement de la pointe du cathéter. Les cathétertips dans le ventricule droit peuvent provoquer une ectopie ventriculaire et donneréchantillons variables de teneur en oxygène., Des échantillons veineux mélangés sont obtenusà partir d’un cathéter d’artère pulmonaire.
Les valeurs normales sont une pression partielle moyenne D’O2 dans le sang veineux mixte de 40 mmHg(SVO2 75 %).
dans la mesure du possible, le patient ne doit pas être stimulé ou perturbé pendant plusieurs minutes avant le prélèvement. Des précautions doivent être prises pour éviter l’aspiration des voies respiratoires et d’autres procédures pendant cette période. L’échantillon veineux artériel et mixte doit être prélevésimultanément. Des précautions doivent être prises pour éviter les erreurs d’échantillonnage,en particulier à partir du cathéter de l’artère pulmonaire.,
lorsque des échantillons de sang sont prélevés dans l’artère pulmonaire, l’échantillon doit être prélevé lentement car une aspiration rapide peut entraîner un mélange de sang capillaire pulmonaire et de sang de l’artère pulmonaire, provoquant une augmentation spectaculaire de la teneur en oxygène .
l’écoulement rapide des fluides intraveineux via un cathéter veineux central ou plusieurs ports proximaux du cathéter Pa peut contaminer le sang prélevé dans l’orifice distal du cathéter PA et provoquer des déterminations erronées de l’hémoglobine et des calculs de teneur en oxygène.
Les valeurs Cao 2 et Cvo2 sont calculées., Il ne devrait pas y avoir plus de 1 g/dldifférence entre la teneur en hémoglobine des deux échantillons. Une moyenne des deux est recommandée pour les calculs si la différence est supérieure à 0,5 g / dL.
Il est recommandé que la carboxyhémoglobine soit mesurée ou supposée être de 1,5 % . La valeur de la CO2 est ensuite calculée en utilisant la teneur moyenne ou artérielle en hémoglobine et en supposant que la pression partielle D’O2 dans le lit capillaire est égale à lapao2. Si le PaO2 estplus grand que 150 mmHg, toute l’hémoglobine disponible est supposée être saturée.
True shunt est réfractaire à l’oxygénothérapie., Il en résulte ce qui est appelé « hypoxémie réfractaire ». Étant donné que l’hypoxémie réfractaire ne répond pas à l’oxygénothérapie, il convient de rechercher d’autres moyens pour améliorer l’oxygénation artérielle. Ceux-ci peuvent inclure le traitement de la pathologie du underlying, l’application de la thérapie Positive de fin ExpiratoryPressure (PEEP) ou la teneur en oxygène croissante pour maintenir la livraison acceptable de l’oxygène.
Les causes les plus fréquentes de réfractairela hypoxémie est divisée en cardiaque et pulmonaire., Les causes pulmonaires les plus courantesles pneumonites consolidées, l’atélectasie,le néoplasme ou le syndrome de détresse respiratoire aiguë/poumon aigu.
Shunt et PEEP
étant donné que le shunt vrai ne répond pas à l’oxygène, une pression expiratoire positive ou un traitement PEEP peuvent être appliqués aux poumons affaiblis pour aider à réduire le QSP / QT. Parmi les réponses physiologiques observées avec PEEP figurent une meilleure oxygénation, une capacité résiduelle fonctionnelle accrue, une meilleure conformité pulmonaire et une diminution du shunt.,
la diminution du shunt observée avec PEEPis est généralement attribuée au recrutement alvéolaire ou à une augmentation de la capacité résiduelle fonctionnelle secondaire à l’inflation des alvéoles précédemment effondrées .
Gattinoni a décrit en utilisant la tomodensitométrie la distribution régionale de gaz dans les tissus lors du titrage de PEEP . Ces études ont confirmé le point d’inflexion classique de la courbe gaz/tissu, qui est compatible avec le recrutement alvéolaire .
la réponse de la PEEPtitration varie non seulement avec le type de pathologie pulmonaire, mais aussiavec la région du poumon étudiée., Les régions pulmonaires plus dépendantes sous-tendent de plus grands degrés de recrutement alvéolaire tandis que les régions pulmonaires moins dépendantes ont tendance à connaître une augmentation plus importante du volume alvéolaire sans recrutement, et les régions pulmonaires qui ne répondent pas à la PEEP sont également réparties dans tout le poumon.
D’autres méthodes d’amélioration de l’oxygénation comprennent le positionnement enclin,ce qui augmente l’homogénéité du processus intrapulmonaire etaméliore la ventilation .