Configuration électronique
Les électrons d’un atome remplissent ses orbitales atomiques selon le principe D’Aufbau; « Aufbau », en allemand, signifie « construire. »Le principe D’Aufbau, qui incorpore le principe D’Exclusion de Pauli et la règle de Hund prescrit quelques règles simples pour déterminer l’ordre dans lequel les électrons remplissent les orbitales atomiques:
- Les électrons remplissent toujours les orbitales d’énergie inférieure en premier. 1S est rempli avant 2s, et 2s avant 2p.,
- Le principe D’Exclusion de Pauli stipule que deux électrons dans un atome particulier ne peuvent pas avoir de nombres quantiques identiques. En fonction, ce principe signifie que si deux électrons occupent la même orbitale, ils doivent avoir un spin opposé.
- La règle de Hund stipule que lorsqu’un électron rejoint un atome et doit choisir entre deux orbitales ou plus de la même énergie, l’électron préférera entrer dans une orbitale vide plutôt que dans une orbitale déjà occupée., Comme plus d’électrons sont ajoutés à l’atome, ces électrons ont tendance à remplir à moitié les orbitales de la même énergie avant de s’apparier avec les électrons existants pour remplir les orbitales.
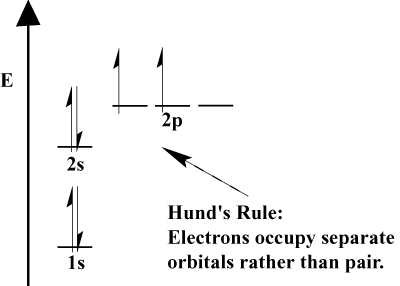
électrons de Valence et de Valence
La Coquille orbitale la plus externe d’un atome est appelée sa coquille de valence, et les électrons dans la coquille de valence sont des électrons de valence. Les électrons de Valence sont les électrons d’énergie la plus élevée dans un atome et sont donc les plus réactifs. Alors que les électrons internes (ceux qui ne sont pas dans la coquille de valence) ne participent généralement pas à la liaison chimique et aux réactions, les électrons de valence peuvent être gagnés, perdus ou partagés pour former des liaisons chimiques., Pour cette raison, les éléments ayant le même nombre d’électrons de valence ont tendance à avoir des propriétés chimiques similaires, car ils ont tendance à gagner, perdre ou partager des électrons de valence de la même manière. Le Tableau Périodique a été conçu avec cette fonctionnalité à l’esprit. Chaque élément a un nombre d’électrons de valence égal à son numéro de groupe sur le tableau périodique.
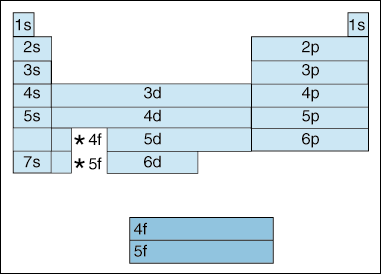
Ce tableau illustre un certain nombre d’intéressant, et complique les, fonctions de configuration électronique.,
Tout d’abord, à mesure que les électrons augmentent en énergie, un changement se produit. Jusqu’à maintenant, nous avons dit que le principe de nombre quantique, augmente le niveau d’énergie de l’orbitale. Et, comme nous l’avons dit plus haut dans le principe D’Aufbau, les électrons remplissent des orbitales d’énergie inférieure avant de remplir des orbitales d’énergie supérieure. Cependant, le diagramme ci-dessus montre clairement que l’orbitale 4s est remplie avant l’orbitale 3d., En d’autres termes, une fois que nous arrivons au principe quantique 3, les sous-couches les plus élevées des nombres quantiques inférieurs éclipsent en énergie les sous-couches les plus basses des nombres quantiques supérieurs: 3d est d’énergie supérieure à 4s.
Deuxièmement, ce qui précède indique une méthode de description d’un élément selon sa configuration électronique. Lorsque vous vous déplacez de gauche à droite dans le tableau périodique, le diagramme ci-dessus montre l’ordre dans lequel les orbitales sont remplis. Si nous étions en fait décomposer le diagramme ci-dessus en groupes plutôt que les blocs que nous avons, cela montrerait exactement combien d’électrons chaque élément A., Par exemple, l’élément de l’hydrogène, situé dans la partie supérieure gauche du tableau périodique, est décrit comme 1s1, avec le s décrivant orbital contient des électrons et l’1 décrivant combien d’électrons résident dans cette orbitale. Le Lithium, qui réside sur le tableau périodique juste en dessous de l’hydrogène, serait décrit comme 1s22s1. Les configurations d’électrons des dix premiers éléments sont présentées ci-dessous (notez que les électrons de valence sont l’électron dans la coquille d’énergie la plus élevée, pas seulement les électrons dans la sous-coquille d’énergie la plus élevée).,

la règle D’Octet
notre discussion sur les configurations d’électrons de valence nous conduit à l’un des principes cardinaux de la liaison chimique, la règle d’octet. La règle de l’octet stipule que les atomes deviennentsurtout stable lorsque leurs coquilles de valence gagnent un complément complet d’électrons de valence. Par exemple, dans ci-dessus, L’hélium (He) et le néon (Ne) ont des coquilles de valence externes qui sont complètement remplies, donc ni l’un ni l’autre n’a tendance à gagner ou à perdre des électrons., Par conséquent, L’hélium et le néon, deux des gaz dits nobles, existent sous forme atomique libre et ne forment généralement pas de liaisons chimiques avec d’autres atomes.
cependant, la plupart des éléments n’ont pas une enveloppe extérieure complète et sont trop instables pour exister en tant qu’atomes libres. Au lieu de cela, ils cherchent à remplir leurs coquilles d’électrons externes en formant des liaisons chimiques avec d’autres atomes et atteignent ainsi une configuration de gaz Noble. Un élément aura tendance à prendre le chemin le plus court pour atteindre la configuration des gaz nobles, que cela signifie gagner ou perdre un électron., Par exemple, le sodium (Na), qui a un seul électron dans son orbitale 3S externe, peut perdre cet électron pour atteindre la configuration électronique du néon. Le chlore, avec sept électrons de valence, peut gagner un électron pour atteindre la configuration de l’argon. Lorsque deux éléments différents ont la même configuration électronique, ils sont appelés isoélectroniques.
diamagnétisme et paramagnétisme
la configuration électronique d’un atome a également des conséquences sur son comportement par rapport aux champs magnétiques. Un tel comportement dépend du nombre d’électrons d’un atome qui sont appariés en spin., Rappelez-vous que la règle de Hund et le principe D’Exclusion de Pauli se combinent pour dicter que les orbitales d’un atome seront toutes à moitié remplies avant de commencer à se remplir complètement, et que lorsqu’elles se remplissent complètement avec deux électrons, ces deux électrons auront des spins opposés.
un atome avec toutes ses orbitales remplies, et donc tous ses électrons appariés avec un électron de spin opposé, sera très peu affecté par les champs magnétiques. De tels atomes sont appelés diagmétiques. Inversement, les atomes paramagnétiques n’ont pas tous leurs électrons appariés en rotation et sont affectés par des champs magnétiques., Il existe des degrés de paramagnétisme, car un atome peut avoir un électron non apparié, ou il peut en avoir quatre.