L’élément chimique de l’aluminium est considéré comme un autre métal. Il a été découvert dans les années 1750 par Andreas Marggraf.,

Data Zone
| Classification: | Aluminum is an ‘other metal’ |
| Color: | silvery |
| Atomic weight: | 26.98154 g/mol |
| State: | solid |
| Melting point: | 660.32 oC, 933.57 K |
| Boiling point: | 2466.85 oC, 2740.,00 K |
| Electrons: | 13 |
| Protons: | 13 |
| Neutrons in most abundant isotope: | 14 |
| Electron shells: | 2,8,3 |
| Electron configuration: | 1s2 2s2 2p6 3s2 3p1 |
| Density @ 20oC: | 2.702 g/cm3 |
Show more, including: Heats, Energies, Oxidation,
Reactions, Compounds, Radii, Conductivities
| Atomic volume: | 9.,98 cm3/mol | ||
| Structure: | fcc: face-centered cubic | ||
| Hardness: | 2.8 mohs | ||
| Specific heat capacity | 0.90 J g-1 K-1 | ||
| Heat of fusion | 10.790 kJ mol-1 | ||
| Heat of atomization | 326 kJ mol-1 | ||
| Heat of vaporization | 293.40 kJ mol-1 | ||
| 1st ionization energy | 577.6 kJ mol-1 | ||
| 2nd ionization energy | 1816.6 kJ mol-1 | ||
| 3rd ionization energy | 2744.,7 kJ mol-1 | ||
| Electron affinity | 42.6 kJ mol-1 | ||
| Minimum oxidation number | 0 | ||
| Min. common oxidation no. | 0 | ||
| Maximum oxidation number | 3 | ||
| Max. common oxidation no. | 3 | ||
| Electronegativity (Pauling Scale) | 1.61 | ||
| Polarizability volume | 8.,> | Reaction with 15 M HNO3 | passivated |
| Reaction with 6 M HCl | mild, ⇒ H2, AlCl3 | ||
| Reaction with 6 M NaOH | mild, ⇒ H2, – | ||
| Oxide(s) | Al2O3 | ||
| Hydride(s) | AlH3 | ||
| Chloride(s) | AlCl3 & Al2Cl6 | ||
| Atomic radius | 125 pm | ||
| Ionic radius (1+ ion) | – | ||
| Ionic radius (2+ ion) | – | ||
| Ionic radius (3+ ion) | 53.,5 pm | ||
| Ionic radius (1- ion) | – | ||
| Ionic radius (2- ion) | – | ||
| Ionic radius (3- ion) | – | ||
| Thermal conductivity | 237 W m-1 K-1 | ||
| Electrical conductivity | 37.6676 x 106 S m-1 | ||
| Freezing/Melting point: | 660.32 oC, 933.,57 K |
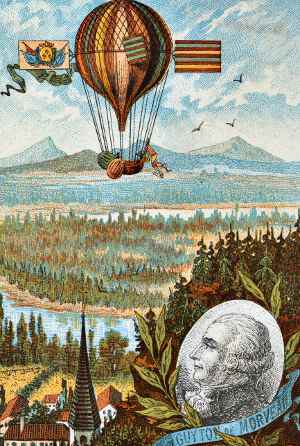
– Louis-de-Morveau cru un nouveau métal peut être découvert dans de l’oxyde d’alumine. Il avait raison, mais il était incapable de l’isoler. De Morveau a conçu la première méthode systématique pour nommer les produits chimiques, et, comme nous pouvons le voir, il était un ballooniste pionnier.,
Aluminum’s Periodic Table
Neighborhood
| Group 2 or 12 |
Group 13 |
Group 14 |
|
| 2 | 4 Be |
5 B |
6 C |
| 3 | 12 Mg |
13 Al |
14 Si |
| 4 | 30 Zn |
31 Ga |
32 Ge |
Discovery of Aluminum
Les gens utilisent l’alun depuis l’Antiquité pour la teinture, le bronzage et pour arrêter les saignements. L’alun est le sulfate d’aluminium de potassium.
dans les années 1750, le chimiste allemand Andreas Marggraf a découvert qu’il pouvait utiliser une solution alcaline pour précipiter une nouvelle substance à partir de l’alun. Marggraf avait déjà été la première personne à isoler le zinc en 1746.
La substance Marggraf obtenue à partir d’alun a été nommée alumine par le chimiste français Louis de Morveau en 1760. Nous savons maintenant que l’alumine est l’oxyde d’aluminium – formule chimique Al2O3.,
De Morveau croyait que l’alumine contenait un nouvel élément métallique, mais, comme Marggraf, il était incapable d’extraire ce métal de son oxyde. (1), (2)
en 1807 ou 1808, le chimiste anglais Humphry Davy décompose l’alumine dans un arc électrique pour obtenir un métal. Le métal n’était pas de l’aluminium pur, mais un alliage d’aluminium et de fer.
Davy a appelé le nouveau métal alumium, puis l’a rebaptisé aluminium. (3)
L’aluminium a été isolé pour la première fois en 1825 par Hans Christian Ørsted (Oersted) à Copenhague, au Danemark, qui a rapporté: « un morceau de métal qui, en couleur et en lustre, ressemble un peu à l’étain., »
Ørsted produisait de l’aluminium en réduisant le chlorure d’aluminium à l’aide d’un amalgame potassium-Mercure. Le mercure a été éliminé par chauffage pour laisser de l’aluminium.
le chimiste allemand Friedrich Wöhler (Woehler) a répété L’expérience D’Ørsted mais a constaté qu’elle ne donnait que du potassium métal. Wöhler a développé la méthode deux ans plus tard, faisant réagir du trichlorure d’aluminium volatilisé avec du potassium pour produire de petites quantités d’aluminium. (1)
en 1856, Berzelius déclara que C’était Wöhler qui avait réussi en 1827. Wöhler est donc généralement crédité pour la découverte.,
plus récemment, Fogh a répété les expériences originales et a montré que la méthode D’Ørsted peut donner des résultats satisfaisants.
cela a renforcé la priorité du travail original D’Ørsted et sa position de découvreur de l’aluminium. (4)
pendant près de trois décennies, l’aluminium est resté une nouveauté, cher à produire et plus précieux que l’or, jusqu’à ce Qu’en 1854 Henri Saint-Claire Deville à Paris, France trouve un moyen de remplacer le potassium par du sodium beaucoup moins cher dans la réaction pour isoler l’aluminium., L’aluminium est alors devenu plus populaire mais, parce qu’il était encore assez cher, a été utilisé dans des situations ornementales plutôt que pratiques.
enfin, en 1886, le chimiste américain Charles Martin Hall et le chimiste français Paul Héroult inventent indépendamment le procédé Hall-Héroult, qui isole à peu de frais l’aluminium métallique de son oxyde électrolytiquement.
l’aluminium est toujours fabriqué selon le procédé Hall-Héroult aujourd’hui.
faits intéressants sur L’aluminium
- la fabrication de l’aluminium prend beaucoup d’énergie – 17.,4 mégawattheures d’énergie électrique pour produire une tonne d’aluminium; que trois fois plus d’énergie que ce qui est nécessaire pour faire une tonne d’acier. (5)
- l’Aluminium est un excellent métal à recycler. Le recyclage utilise seulement 5% de l’énergie nécessaire pour produire de l’aluminium à partir de son minerai, La bauxite. (6)
- L’aluminium ne colle pas aux aimants dans des conditions normales.
- Il y a plus d’aluminium dans la croûte terrestre que tout autre métal. À environ 8 pour cent, l’aluminium est le troisième élément le plus abondant dans la croûte de notre planète, derrière l’oxygène et le silicium.,
- malgré sa grande abondance, dans les années 1850, l’aluminium était plus précieux que l’or. En 1852, le prix de l’aluminium était de 1200 per le kg et celui de l’or de 664 per le kg.
- Les prix de l’aluminium illustrent les périls de la spéculation financière: en 1854, Saint-Claire Deville trouve un moyen de remplacer le potassium par du sodium beaucoup moins cher dans la réaction pour isoler l’aluminium. En 1859, le prix de l’aluminium était de 37 kg le kg; son prix avait chuté de 97% en seulement cinq ans.,
- là où l’article précédent met en évidence les dangers de la spéculation, cet article met en évidence l’un des triomphes de la chimie: le procédé électrolytique Hall-Heroult a été découvert en 1886. En 1895, le prix de l’aluminium avait chuté à seulement 1,20 kg le kg.
- Rubis pierres précieuses sont principalement de l’oxyde d’aluminium dans lequel un petit nombre d’ions aluminium ont été remplacés par des ions chrome.
- L’aluminium est fabriqué dans les incendies nucléaires des étoiles lourdes lorsqu’un proton s’ajoute au magnésium. (Le magnésium est lui-même fabriqué dans les étoiles par fusion nucléaire de deux carbones.,) (7)


Apparence et Caractéristiques
effets Néfastes:
Pas éprouvé de problèmes; l’ingestion peut causer la maladie d’alzheimer
Caractéristiques:
l’Aluminium est un métal blanc argenté., Il ne colle pas aux aimants (il est paramagnétique et donc son magnétisme dans des conditions normales est très, très faible). C’est un excellent conducteur électrique. Il est de faible densité et de ductilité élevée. Il est trop réactif pour être communément trouvé comme le métal bien que, très rarement, le métal natif peut être trouvé. (8)
l’aspect de l’aluminium est émoussé et sa réactivité est passivée par un film d’oxyde d’aluminium qui se forme naturellement à la surface du métal dans des conditions normales. Le film d’oxyde produit un matériau résistant à la corrosion., Le film peut être épaissi à l’aide d’électrolyse ou d’agents oxydants et l’aluminium sous cette forme résistera aux attaques des acides dilués, des alcalis dilués et de l’acide nitrique concentré.
L’aluminium se trouve suffisamment loin sur le côté droit du tableau périodique pour montrer quelques indices de comportement non métallique, réagissant avec des alcalis chauds pour former des ions aluminates – ainsi que la réaction plus typique du métal avec des acides pour libérer de l’hydrogène gazeux et former L’ion métallique chargé positivement, Al3+. c’est à dire l’aluminium est amphotère.
l’aluminium pur est assez doux et manque de résistance., L’aluminium utilisé dans les applications commerciales contient de petites quantités de silicium et de fer (moins de 1%), ce qui améliore considérablement la résistance et la dureté.
utilisations de L’aluminium
en raison de sa faible densité, de son faible coût et de sa résistance à la corrosion, l’aluminium est largement utilisé dans le monde entier.
Il est utilisé dans une vaste gamme de produits, des canettes de boissons aux cadres de fenêtres, en passant par les bateaux et les avions. Un Boeing 747-400 contient 147 000 livres (66 150 kg) d’aluminium à haute résistance.
contrairement à certains métaux, l’aluminium n’a pas d’arôme – d’où son utilisation répandue dans les emballages alimentaires et les casseroles.,
bien qu’il ne soit pas aussi bon que l’argent ou le cuivre, l’aluminium est un excellent conducteur électrique. Il est également considérablement moins cher et plus léger que ces métaux, il est donc largement utilisé dans les lignes électriques aériennes.
De tous les métaux, seul le fer est utilisé plus largement que l’aluminium.
abondance et Isotopes
abondance croûte terrestre: 8,23% en poids, 6,32% en moles
abondance système solaire: 56 ppm en Poids, 2,7 ppm en moles
coût, pur: 15,72 per par 100g
coût, en vrac: 0$.,20 par 100 g
Source: l’Aluminium est le métal le plus abondant dans la croûte terrestre et le troisième élément de la croûte terrestre après l’oxygène et le silicium. L’aluminium est trop réactif pour être trouvé pur. La Bauxite (principalement l’oxyde d’aluminium) est le minerai le plus important.
Isotopes: 15 dont les demi-vies sont connues, nombres de masse 22 à 35. Parmi ceux-ci, seulement deux se produisent naturellement: 27Al, qui est stable, et 26Al, qui est radioactif avec une demi-vie de 7,17 x 105 ans. 26Al est formé par le bombardement de rayons cosmiques de l’argon dans l’atmosphère terrestre.,

Citer cette Page
Pour les liens en ligne, s’il vous plaît copiez et collez l’une des opérations suivantes:
<a href="https://www.chemicool.com/elements/aluminum.html">Aluminum</a>
ou
<a href="https://www.chemicool.com/elements/aluminum.html">Aluminum Element Facts</a>
Pour citer cette page dans un document académique, veuillez utiliser les informations suivantes MLA conforme citation:
"Aluminum." Chemicool Periodic Table. Chemicool.com. 26 Jul. 2014. Web. <https://www.chemicool.com/elements/aluminum.html>.