4.2. Œdème vasogénique
Les troubles du compartiment vasculaire sont parmi les causes les plus fréquentes d’œdème interstitiel (œdème vasogénique) et résultent d’une hypertension capillaire ou d’une hypoprotéinémie. La pression capillaire (Pc) est déterminée par la pression artérielle (PA) et veineuse (PV) et le rapport entre les résistances pré – et post-capillaires (RA/RV) comme le montre l’équation :
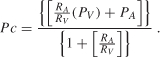
D’après L’équation (4.1), il est évident que la pression capillaire augmente lorsque la pression artérielle ou veineuse augmente et/ou que le rapport de résistance pré – à postcapillaire diminue. Étant donné que la pression artérielle et veineuse et le rapport de résistance pré-à postcapillaire peuvent être modifiés moment par moment dans divers facteurs physiologiques (par exemple,(par exemple, inflammation) ou après l’administration d’agents pharmaceutiques vasoactifs, on peut s’attendre à ce que la pression capillaire et donc le taux de filtration transmicrovasculaire puissent augmenter rapidement en fonction de ces changements. Cependant, il a été suggéré que la pression capillaire peut être étroitement régulée en réponse aux changements de la pression artérielle ou veineuse, par des ajustements appropriés de la résistance pré – ou POST-capillaire, comme moyen de maintenir un volume de liquide interstitiel relativement constant lorsque l’une de ces variables change ., Par exemple, parce que le muscle lisse vasculaire dans les parois artérielles et artériolaires se contracte lorsqu’il est exposé à des pressions intravasculaires élevées, cette réponse myogène augmente la résistance précapillaire et protège les capillaires d’une augmentation concomitante de leur pression intravasculaire. Inversement, lorsque la pression artérielle diminue, le tonus myogène est réduit dans les artérioles, diminuant leur résistance à l’écoulement et maintenant la pression capillaire. Ces observations suggèrent que la pression capillaire peut être régulée sur la même plage de changements de pression sur laquelle le flux est autorégulé dans un organe donné., En effet, à partir de la relation:

on pourrait prédire que la régulation du flux sanguin (Q) serait parfaitement couplée à la régulation de la pression capillaire, en supposant que la pression veineuse et la résistance restent constantes., Cependant, une analyse approfondie des changements dans le rapport de résistance pré-à Post-capillaire et les changements de pression capillaire a indiqué que l’efficacité du débit et de la régulation de la pression capillaire ne sont pas toujours étroitement corrélées, un effet qui peut être dû à des ajustements dimensionnels passifs dans les capillaires et les veinules et à des altérations rhéologiques, En plus de l’effet tampon des ajustements du rapport de résistance pré-à Post-capillaire sur la pression capillaire, l’influence des changements de pression capillaire induits par des altérations de la pression de perfusion est minimisée par des changements directionnels opposés du coefficient de filtration capillaire secondaire au recrutement ou au dérecruitment des capillaires perfusés .
de même, les changements dans la pression capillaire, et donc la filtration capillaire, sont tamponnés lorsque la pression veineuse est élevée . Au moins deux mécanismes expliquent cette régulation de la pression capillaire (Figure 4.1)., La contraction myogénique du muscle lisse vasculaire dans les parois des artérioles est provoquée par la transmission de l’augmentation de la pression veineuse à ces vaisseaux en amont . Un réflexe veineux-artériolaire a également été impliqué dans cette réponse, dans laquelle les élévations de la pression veineuse activent des impulsions antidromiques qui sont transmises aux terminaisons nerveuses frappant les artérioles en amont, où la libération de neurotransmetteurs provoque une constriction . Cependant, des travaux plus récents ont remis en question l’importance de ce mécanisme par rapport à la réponse myogène ., Il est important de noter que la pression capillaire, et donc la filtration capillaire, n’est pas aussi bien régulée en réponse à une augmentation de la pression ou de la résistance veineuse que lorsque la pression artérielle est modifiée . Cependant, les effets potentiels d’une augmentation de la pression veineuse pour réduire le coefficient de filtration capillaire peuvent amortir la réponse à une modification de la pression capillaire sur le mouvement du liquide transmicrovasculaire, comme indiqué ci-dessus.,
bien que la discussion susmentionnée ait porté sur l’effet des changements aigus de la pression veineuse sur la régulation de la pression capillaire et du mouvement du liquide transmicrovasculaire et s’applique à la plupart des organes, le système vasculaire de l’intestin grêle peut être unique dans sa réponse aux changements chroniques de la pression veineuse. L’hypertension veineuse intestinale chronique induite par une sténose calibrée de la veine porte est associée au développement d’une circulation hyperdynamique caractérisée par une augmentation du débit cardiaque, une réduction de la résistance vasculaire intestinale et une augmentation du flux sanguin intestinal ., Ces derniers changements entraînent une augmentation plus importante de la pression capillaire intestinale que lors d’élévations aiguës de la pression veineuse de même ampleur et sont associés à des augmentations du coefficient de filtration capillaire . En conséquence, l’augmentation de la filtration transcapillaire est beaucoup plus importante dans l’hypertension veineuse chronique par rapport à l’hypertension veineuse aiguë., Les mécanismes responsables de la réduction de la résistance vasculaire intestinale qui expliquent les changements dans la pression capillaire et le coefficient de filtration capillaire qui conduisent à une filtration capillaire améliorée dans l’hypertension portale chronique impliquent la formation de substances vasodilatatrices et d’autres facteurs et sont examinés ailleurs .
la pression capillaire n’est que modérément augmentée (~2 mmHg) dans l’hypertension artérielle chronique car l’augmentation de la résistance artérielle qui provoque l’augmentation de la pression artérielle amortit la transmission de l’augmentation de la pression au niveau capillaire ., Néanmoins, l’augmentation associée du taux de filtration transmicrovasculaire explique en grande partie le taux d’échappement transcapillaire élevé des protéines noté dans ce trouble par couplage convectif du flux fluide et protéique. Une pression capillaire et un taux de filtration élevés se produisent tôt au cours du développement du diabète sucré et sont considérés comme un stimulus important pour l’épaississement de la membrane basale capillaire, la caractéristique ultrastructurale de la microangiopathie diabétique ., On a rapporté que la raréfaction microvasculaire, ou la perte de capillaires, accompagnait le développement de l’hypertension artérielle, du diabète sucré et du syndrome métabolique . Les réductions associées de la surface disponible pour l’échange peuvent partiellement compenser l’effet de l’hypertension capillaire pour augmenter le volume de liquide interstitiel dans ces conditions.
de très fortes augmentations de la pression veineuse peuvent induire des augmentations de la filtration capillaire bien supérieures à ce qui serait prédit par l’augmentation associée de la pression capillaire., Ceci est dû aux augmentations induites par la pression de la perméabilité microvasculaire qui se manifestent dans L’équation de Starling par des augmentations de la conductivité hydraulique et des réductions du coefficient de réflexion osmotique., Pour la plupart des organes, les caractéristiques de perméabilité de la barrière microvasculaire à l’échange de fluides et de solutés insolubles dans les lipides peuvent s’expliquer par l’existence d’un grand nombre de petits pores avec des rayons de 70 angstroms ou moins et d’un plus petit nombre de grands pores avec des rayons supérieurs à 200 angstroms, certains modèles incorporant un troisième ensemble de très petits pores (< 10 angstroms de rayon) pour tenir compte du flux diffusionnel de l’eau., (Les organes tels que le foie, qui ont des capillaires discontinus caractérisés par de grands écarts entre les cellules endothéliales et des coefficients de réflexion approchant 0,1, ne correspondent pas à ces modèles). On pense que de grandes augmentations de la pression veineuse élargissent ces pores dans la paroi microvasculaire, ce que l’on appelle le phénomène des pores étirés . Les organes individuels démontrent une sensibilité différentielle à l’effet de la pression veineuse élevée en ce qui concerne l’induction du phénomène de pores d’étirement., Par exemple, aucune augmentation de la perméabilité ne se produit dans les microvaisseaux des pieds pendant une position debout tranquille, même si la pression capillaire dans les pieds augmente de plus de 50 mmHg par rapport aux valeurs mesurées en décubitus dorsal, en raison de la grande colonne hydrostatique dans les artères et les veines. Cependant, les capillaires pulmonaires peuvent démontrer un phénomène de pores étirés dans des conditions telles que l’insuffisance ventriculaire gauche, un effet qui exacerbe la formation d’œdème pulmonaire dans cette condition .,
comme indiqué ci-dessus, la constriction myogénique des artérioles en réponse à l’élévation de la pression artérielle ou veineuse constitue un facteur de sécurité important contre la formation d’œdème dans l’œdème hydrostatique en limitant l’augmentation de la pression capillaire et en réduisant le nombre de capillaires perfusés, et donc la surface disponible pour la filtration du fluide, qui pourrait autrement se produire en réponse à une hypertension artérielle ou veineuse ou à une résistance veineuse accrue (Figure 4.1)., Cependant, il est important de noter que même des augmentations modestes de la pression capillaire, qui peuvent sembler faibles et sans conséquence, peuvent entraîner des augmentations substantielles des taux de filtration des fluides à travers la microvasculature. C’est parce que la pression nette normale de filtration est assez petite, en moyenne 0.15 mmHg pour un capillaire prototypique de corps. Ainsi, l’augmentation de la pression capillaire de seulement 2 mmHg, comme indiqué ci-dessus dans l’hypertension artérielle, entraîne une augmentation initiale de 14 fois du mouvement liquide du sang dans l’interstitium., L’hypertension capillaire entraîne la formation d’un ultrafiltrat pauvre en protéines qui, à l’entrée dans l’espace interstitiel, augmente le volume de liquide interstitiel. En raison des caractéristiques de conformité de l’interstitium, de petits incréments dans le volume interstitiel produisent de très grandes augmentations de la pression tissulaire, ce qui réduit efficacement le gradient de pression hydrostatique transcapillaire, limitant ainsi l’accumulation supplémentaire de liquide (Figure 4.1). Cet effet est exacerbé en réponse à des élévations de la pression d’écoulement veineux par le phénomène de renflement veineux., C’est-à-dire que le volume dans les veines augmente immédiatement à l’élévation de la pression veineuse, ce qui produit une augmentation coïncidente de la pression interstitielle causée par l’expansion des veinules et des veines engorgées dans les espaces interstitiels (Figure 4.1). Essentiellement, l’engorgement veineux déplace la courbe de conformité interstitielle vers la gauche, de sorte qu’un changement plus petit du volume interstitiel produit une augmentation plus importante de la pression interstitielle. L’augmentation de la pression du liquide interstitiel augmente le flux lymphatique par trois mécanismes., Tout d’abord, une pression tissulaire accrue fournit la pression motrice pour l’écoulement dans les lymphatiques initiaux. Deuxièmement, une pression accrue dans le compartiment interstitiel crée une tension radiale sur les filaments d’ancrage reliant la matrice extracellulaire aux cellules endothéliales lymphatiques, augmentant localement le diamètre lymphatique initial et ouvrant des espaces entre les jonctions interdigitantes et chevauchantes entre les cellules endothéliales lymphatiques adjacentes (Figure 3.1)., Ces forces de tension créent une petite pression d’aspiration transitoire pour le mouvement du liquide interstitiel à travers des espaces élargis entre les cellules endothéliales adjacentes, qui agissent comme un deuxième système de valve unidirectionnelle pour assurer un écoulement unidirectionnel de l’interstitium vers les lymphatiques. Troisièmement, lorsque le liquide se déplace dans les lymphatiques initiaux, il augmente le volume des lymphangions en amont, favorisant leur activité contractile et leur flux lymphatique. La présence de valves entre les lymphangions adjacents assure un écoulement à Sens Unique.,
comme indiqué ci-dessus, l’hypertension capillaire entraîne le mouvement du liquide pauvre en protéines dans les espaces interstitiels, réduisant la concentration de protéines tissulaires et diminuant la pression osmotique colloïdale tissulaire (Figure 4.1). Ceci augmente l’efficacité du gradient de pression oncotique transcapillaire (nc − nt) à s’opposer au gradient hydrostatique (Pc − Pt) favorisant la filtration., Parce que le soluté est exclu d’une grande partie de l’eau de gel dans la matrice extracellulaire, la rapidité de la diminution de la concentration de protéines tissulaires qui se produit en réponse à l’augmentation du volume de liquide interstitiel est améliorée, augmentant ainsi l’efficacité du lavage des protéines en tant que facteur de sécurité de l’œdème., Il est important de noter que l’efficacité des diminutions de la pression osmotique tissulaire en tant que facteur de sécurité de l’œdème est réduite dans l’hypertension capillaire sévère, en raison du phénomène de pores étirés discuté ci-dessus, qui augmente le transport des protéines couplées par convection dans les espaces tissulaires.