Einführung
Fett abgeleitete Stromazellen (ASC) sind multipotente und immunoprivileged, so dass Sie ideale Kandidaten für therapeutische Zwecke (Bourin et al., 2013; Ma et al., 2014; Kallmeyer und Pfeffer, 2015). ASCs können mit minimalinvasiven Techniken aus verschiedenen Fettgewebedepots im Körper isoliert werden (Zuk et al., 2001)., Sie zeichnen sich durch ihre Fähigkeit aus, an Kunststoff zu haften, ein einzigartiges Oberflächenmarkerprofil und die Fähigkeit, sich in Knochen, Fett und Knorpel zu differenzieren (Dominici et al., 2006; Bourin et al., 2013). ASC umfassen ~15-30% der stromalen vaskulären Fraktion (SVF) des Fettgewebes (Bourin et al., 2013; Zuk, 2013) und müssen ex vivo erweitert werden, um ausreichende Zellzahlen für therapeutische Zwecke zu erhalten.,
Die Bereitstellung sicherer und regulierter Zelltherapieprodukte für Patienten erfordert die Einhaltung guter Herstellungspraktiken (GMP), und die GMP-Richtlinien sollten während des gesamten Prozesses der Isolierung, Erweiterung und Differenzierung von ASCs eingehalten werden (Giancola et al., 2012). Die zahlreichen Reagenzien, die zur Isolierung und Erweiterung von ASCs zu Forschungszwecken verwendet werden, stammen von Tieren oder sind nicht klinisch hochwertig; Daher müssen diese durch geeignetere Alternativen gemäß den GMP-Standards ersetzt werden (Halme und Kessler, 2006; Riis et al., 2015)., Wir überprüfen die Wahl der Serumergänzung, die anstelle von fetalem Rinderserum (FBS) zur ASC-Erweiterung verwendet werden kann, und beschreiben ihre Wirkungen in vitro und in vivo, wie in der Literatur berichtet.,
Richtlinien und Techniken der International Society of Cellular Therapy (ISCT) und International Fat Applied Technology Society (IFATS) zur Bewertung der Eigenschaften von Fettablagerungen
Eine Reihe minimaler Kriterien und Richtlinien wurden von der International Society of Cellular Therapy (ISCT) und der International Fat Applied Technology Society (IFATS) zur Charakterisierung von ASCs empfohlen (Dominici et al., 2006; Bourin et al., 2013)., Diese Kriterien umfassen die Fähigkeit der ASCs, an Kunststoff zu haften, ihr Oberflächenmarkerprofil und ihr Trilineage-Differenzierungspotential. Das neueste Positionspapier beschreibt Lebensfähigkeit und Proliferation als zusätzliche Messungen zu den ursprünglichen Charakterisierungskriterien. Darüber hinaus wurden experimentelle Methoden und Assays zur Messung der Charakterisierungskriterien definiert (Bourin et al., 2013)., Es hat sich gezeigt, dass diese Kriterien von zahlreichen Faktoren wie der Fettabsaugungstechnik, der SVF-Isolationstechnik sowie den während des Expansionsprozesses verwendeten Medien und Supplementierungen beeinflusst werden (Koellensperger et al., 2014; Bajek et al., 2015; Busser, et al., 2015). Gemäß den ISCT-und IFATS-Richtlinien wird empfohlen und akzeptiert, die Einhaltung der oben genannten Richtlinien für jeden Isolations-und Kulturzustand zu bestätigen, um die resultierende Zellpopulation als ASCs zu klassifizieren.,
Techniken und Methoden zur Charakterisierung von ASCs
Morphologie und Adhärenz
Einmal ausgesät, zeigen adhärente ASCs eine ausgeprägte Morphologie, die als dünn, länglich und spindelförmig beschrieben werden kann. Die morphologische Beurteilung von ASCs wird üblicherweise mittels Lichtmikroskopie vorgeformt (Trojahn Kølle et al., 2013).
Proliferation
Die ISCT-und IFATS-Richtlinien haben empfohlen, die Proliferation und Häufigkeit von Vorläufer-ACSs durch einen fibroblastoidkoloniebildenden Unit-Assay zu messen (Bourin et al., 2013)., Andere Techniken, die in den in dieser Übersicht zitierten Studien verwendet werden, verwenden das Zählen lebensfähiger Zellen oder das Messen der Proliferationskapazität von ASCs mithilfe der Immunhistochemie. Zählmethoden umfassen (1) Zählen der Zellen unter Verwendung eines Lebensfähigkeitsfarbstoffs und eines Hämozytometers, (2) Zählen der Zellen unter Verwendung von Zählperlen oder Färbetechniken und durchflusszytometrischer Analyse und (3) Verwenden von kolorimetrischen Assays, die lebensfähige Zellen in einem Spektralphotometer messen (Gharibi und Hughes, 2012; Trojahn Kølle et al., 2013; Bogdanova et al., 2014; Atashi et al., 2015; Johal et al., 2015; Oikonomopoulos et al., 2015).,
Immunophenotyp
Die ISCT-und IFATS-Richtlinien haben die Expression mehrerer Oberflächenmarker und ihre erwarteten Prozentsätze als feste Anforderung in ihrer Positionsangabe aufgeführt. Sie haben auch empfohlen, die Oberflächenmarkerexpression durch mehrfarbige Antikörperfärbung zu messen (Bourin et al., 2013). Studien in dieser Überprüfung verwendeten die durchflusszytometrische Analyse, um die Oberflächenmarkerexpression zu messen (Müller et al., 2006; Lindroos et al., 2009; Chieregato et al., 2011; Josh et al., 2012; Trojahn Kølle et al., 2013; Bogdanova et al., 2014; Patrikoski et al., 2014).,
Trilineage Differenzierung
Die Differenzierung in Fett, Knochen und Knorpel wurde traditionell unter Verwendung von histochemischen Färbetechniken gemessen, die unter Mikroskopie visualisiert wurden; Die ISCT-und IFATS-Richtlinien haben jedoch empfohlen, qualitative Bewertungen durch quantitative Ansätze wie die Messung der abstammungsspezifischen mRNA-Expression unter Verwendung von RT-qPCR-Techniken (Reverse Transcription quantitative Polymerase Chain Reaction) zu ersetzen oder zu ergänzen (Bourin et al., 2013)., Die Techniken, die zur Messung der Differenzierungskapazität verwendet wurden, die in den in dieser Übersicht zitierten Studien beschrieben wurden, haben von der histochemischen Färbung bis zur herkömmlichen PCR und RT-qPCR variiert. Histochemische Färbetechniken umfassen das Färben der Zellen entweder mit (1) Ölrot O und Nilrot für Adipogenese; (2) Alizarinrot S, alkalische Phosphatase und von Kossa für Osteogenese; oder (3) Alcianblau und Safranin für Chondrogenese (Müller et al., 2006; Kocoemer et al., 2007; Hebert et al., 2010; Rajala et al., 2010; Koellensperger et al., 2014; Oikonomopoulos et al., 2015; Riis et al., 2016).,
Serumergänzung
Fetales Rinderserum
FBS ist das traditionelle Serumergänzungsmittel, das für die Zellkultur verwendet wird. FBS enthält Wachstumsfaktoren (GFs) und andere Elemente, die für die ASC-Anheftung, – expansion, – wartung und-Proliferation in vitro unerlässlich sind (Lennon et al., 1995, 1996; Zuk et al., 2001; van der Valk et al., 2010). FBS ist anfällig für Batch-to-Batch-Variation, Xenoimmunisierung und mögliche Kontamination mit Mykoplasmen, Viren, Endotoxinen und Prionen (van der Valk et al., 2004, 2010; Chieregato et al., 2011; Kyllonen et al., 2013; Jin et al., 2015)., Die Quelle und Qualität von FBS kann die Proliferation und Differenzierung von ASCs beeinflussen, und das routinemäßige Screening auf Mykoplasmen, Endotoxine und Viren ist wichtig geworden (Naaijkens et al., 2012). Diese Faktoren können die experimentellen Ergebnisse beeinflussen und das Zellprodukt für die klinische Anwendung unsicher machen (Zuk et al., 2001; van der Valk et al., 2004; Witzeneder et al., 2013).
ASCs sind immunprivilegiert, ohne die Expression des Haupthistokompatibilitätskomplexes Klasse II sowie T-und B-Zell-Costimulationsmoleküle (CD80, CD86 und CD40)., Die In-vitro-Immunogenität und immunsuppressiven Eigenschaften von ASCs werden üblicherweise durch Co-Kultivierung der ASCs mit peripheren mononukleären Blutzellen in gemischten Lymphozytenreaktionen und Messung der T-Zell-Proliferationsreaktion gemessen (McIntosh et al., 2006; Patrikoski et al., 2014). ASCs zeigen immunmodulatorische und immunsuppressive Eigenschaften, wie ihre Fähigkeit, die T-Zellfunktion zu regulieren und die Zytokinsekretion in vitro und in vivo zu modulieren (Leto Barone et al., 2013; Roemeling-van Rhijn et al., 2013; Patrikoski et al., 2014)., Diese Eigenschaften ergeben sich aus der geringen Immunogenität von ASC. Die Mehrheit der klinischen Studien mit ASC und anderen mesenchymalen Stammzellen (MSC) (Phase I, II und III) verwendet FBS-ergänzte Medien, und es wurde berichtet, dass immunogene Wirkungen durch Komponenten von FBS bei menschlichen Probanden hervorgerufen werden (Sundin et al., 2007; Riis et al., 2015). Zum Beispiel fand eine klinische Studie mit Knochenmark-abgeleiteten MSCs (BM-MSCs), die in FBS expandierten, Antikörper gegen Komponenten von FBS (Horwitz et al., 2002)., Immunantworten auf FBS wie Arthus und anaphylaktische Reaktionen wurden in klinischen Studien berichtet, in denen Patienten mit dendritischen Zellen und Lymphozyten behandelt wurden, die FBS ausgesetzt waren (Selvaggi et al., 1997; Mackensen et al., 2000). Im Gegensatz dazu ergab eine Metaanalyse von MSC-klinischen Studien, dass über 75% der Experimente FBS in ihren Zellexpansionsprotokollen verwendeten und nur eine Studie Nebenwirkungen auf FBS überwachte und nachwies (Lalu et al., 2012)., In-vivo-Studien, in denen die Immunantwort von Mäusen auf ASCs untersucht wurde, zeigten eine konservierte Immunsuppression und Immunmodulation, eine geringe Immunogenität und keine Reaktion auf FBS (Cho et al., 2009; González et al., 2009). Obwohl ASCs in klinischen Studien ausgiebig getestet werden, muss ihre endgültige Verwendung als Therapeutikum noch festgestellt werden. Dies wird durch die Verwendung von präklinischen Modellen, die möglicherweise nicht biologisch relevant sind, noch verstärkt (Monsarrat et al., 2016). Darüber hinaus kann FBS bei Mäusen und anderen Tiermodellen weniger immunogen sein als beim Menschen., Schließlich die von FBS ausgelöste Immunantwort (Selvaggi et al., 1997; Mackensen et al., 2000; Horwitz et al., 2002) könnte die Abstoßung transplantierter Zellen in der zellbasierten Therapie denkbar beeinflussen.
Serumfreie Alternativen
Die unbekannte und undefinierte Zusammensetzung von FBS ist ein großer Nachteil. Eine bevorzugte Alternative wäre ein chemisch definiertes Medium mit einer bekannten Zusammensetzung wie handelsübliche serumfreie (SF) oder XF-Medien (Usta et al., 2014)., Es wird fälschlicherweise angenommen, dass diese serumfreien Medien keine tierischen Produkte enthalten, da die Begriffe SF und XF häufig austauschbar verwendet werden. SF-Medien werden jedoch üblicherweise mit tierischem oder menschlichem Serumalbumin und GFs in undefinierten Mengen ergänzt (Patrikoski et al., 2013). Xeno-freie Medien hingegen sind chemisch definierte Medien, die gut definierte Komponenten in spezifischen Konzentrationen enthalten (Usta et al., 2014).
Wachstumsfaktoren
Eine weitere Alternative zu Serum ist die Zugabe von GFs zu Kulturmedium, entweder isoliert oder als Cocktail., Diese GFs können synthetisch, tierisch oder vom Menschen abgeleitet sein. Der Ersatz durch synthetische GFs ist aufgrund ihrer höheren Qualität und infolge der Standardisierung zwischen den Chargen vorzuziehen, was für tier – oder vom Menschen abgeleitete GFs möglicherweise nicht möglich ist. Häufig verwendete GFs sind Fibroblastenwachstumsfaktor, epidermaler Wachstumsfaktor und von Thrombozyten abgeleiteter Wachstumsfaktor (PDGF; Baer und Geiger, 2012; Ahearne et al., 2014). Die Zugabe von GFs wurde mit einer Zunahme der Proliferation in Verbindung gebracht (Hebert et al., 2010; Gharibi und Hughes, 2012)., Ein verbessertes adipogenes Differenzierungspotential wurde zuvor in ASCs berichtet, die in einem ergänzten Medium expandierten (Hebert et al., 2010). Eine andere Studie beobachtete jedoch einen negativen Effekt auf die adipogene und osteogene Differenzierung bei langfristig kultivierten ASCs (Gharibi und Hughes, 2012).
Serumalbumin
Serumalbumin ist ein reichlich vorhandenes Plasmaprotein und kann von Menschen und Tieren isoliert werden. Oft werden SF-Medien mit Serumalbumin ergänzt., Studien zum Vergleich von humanem Serumalbumin zur ASC-Medienergänzung haben eine verbesserte Proliferation, eine kleinere spindelartige Morphologie und eine konservierte Differenzierung in Fett, Knochen und Knorpel ergeben (Rajala et al., 2010; Johal et al., 2015).
Chemisch definiertes XF-Medium
Xeno-freies Medium wurde als Ersatz für FBS und Serum empfohlen, da es die notwendigen Komponenten für die ASC-Expansion enthält, keine Spender-oder Batch-to-Batch-Variation beinhaltet, GMP-konform ist und eine minimale Immunogenität und eine günstige Immunsuppression aufweist (van der Valk et al., 2004, 2010; Usta et al.,, 2014). Im Vergleich zu FBS hat die Verwendung von XF-Medium zur Erweiterung von ASCs zu einer besseren morphologischen Qualität, einer erhöhten Proliferation, einem vergleichbaren Immunphänotyp und Differenzierung in Fett, Knochen und Knorpel geführt (Lindroos et al., 2009; Patrikoski et al., 2013; Oikonomopoulos et al., 2015). Die Verwendung von XF-Medien bei der ASC-Expansion führt dazu, dass ASCs ihre Fähigkeit verlieren, an Kunststoff zu haften (Kyllonen et al., 2013; Patrikoski et al., 2013; Oikonomopoulos et al., 2015). Zusätzliche Beschichtungsmittel werden benötigt, um die inhärente Eigenschaft der Kunststoffhaftung im Zusammenhang mit ASCs aufrechtzuerhalten., Kommerziell erhältliches XF-Medium ist teuer und die Herstellung eines internen XF-Mediums kann zeitaufwändig sein und das Risiko von Batch-to-Batch-Variationen erhöhen (Lund et al., 2009; Baer et al., 2010; Rajala et al., 2010; Yang et al., 2012; Kyllonen et al., 2013; Patrikoski et al., 2013; Oikonomopoulos et al., 2015).
Menschliche Alternativen
Menschliche Alternativen können FBS-und SF/XF-ergänzte Medien ersetzen und eine Kulturumgebung schaffen, die der menschlichen Umwelt genauer ähnelt (Azouna et al., 2012; Koellensperger et al., 2014)., Darüber hinaus macht die Verwendung von autologen Produkten (die von derselben Person stammen) den Test auf infektiöse und andere Krankheitserreger überflüssig.
Menschliches Serum
Nachdem Vollblut in Abwesenheit eines Antikoagulans gerinnen durfte und zentrifugiert wurde, ist Serum der resultierende flüssige Teil, der keine Blutplättchen, weißen Blutkörperchen oder roten Blutkörperchen enthält (Abbildung 1; Stedman, 2006). Humanserum (HS) kann entweder autolog (Spender und Empfänger sind die gleiche Person) oder allogen (abgeleitet von Individuen, die sich vom Empfänger unterscheiden) sein., Sowohl autologe als auch allogene HS sind FBS überlegen (Stute et al., 2004; Bieback et al., 2009, 2012; Bernardo et al., 2011; Kyllonen et al., 2013; Patrikoski et al., 2013). In HS expandierte ASCs weisen eine größere Transkriptomstabilität auf als die in FBS expandierten, während Gene, die für die Verlängerung, Differenzierung und extrazelluläre Matrix-und Prostaglandinsynthese des Zellzyklus verantwortlich sind, in FBS im Vergleich zu HS mithilfe der Mikroarrayanalyse hochreguliert und überexprimiert werden (Shahdadfar et al., 2005)., ASCs expandierten in FBS erreichten früher Seneszenz und zeigten eine Telomerverkürzung im Vergleich zu ASCs expandierten in HS (Shahdadfar et al., 2005). Die Wahl von HS scheint wenig Einfluss auf die immunmodulatorischen Eigenschaften von ASCs zu haben. ASCs, die entweder in allogenen HS-oder FBS-haltigen Medien expandierten, hatten eine geringe Immunogenität und führten zu einer Immunsuppression (Patrikoski et al., 2014). ASCs, die in autologem oder allogenem HS expandierten, zeigten im Vergleich zu ASCs, die in FBS expandierten, eine größere Proliferation und einen nicht unterscheidbaren Immunphänotyp (Josh et al., 2012; Bogdanova et al., 2014)., In allogenen HS expandierte ASCs wurden in Fett, Knochen und Knorpel differenziert, obwohl die Hochregulation von chondrogenen und osteogenen Genen im Vergleich zu FBS begünstigt wurde (Josh et al., 2012). ASCs, die in autologen HS expandierten, wurden in Fett und Knorpel differenziert; Die Fähigkeit, sich in Knochen zu differenzieren, war jedoch weniger begünstigt (Bogdanova et al., 2014). Autologes HS kann ASCs im Vergleich zu allogenem HS eine bessere Proliferation und genomische Stabilität bieten, wie sie durch Mikroarray-Analyse bestimmt wird (Shahdadfar et al., 2005; Bieback et al., 2009; Bernardo et al., 2011)., ASCs expandierte in allogenen HS trat in Wachstumsstillstand und unterzog sich Zelltod (Shahdadfar et al., 2005; Lindroos et al., 2009), was die potenziellen Vorteile allogener HS begrenzt. Während autologes HS ideal sein könnte, ist seine Verfügbarkeit begrenzt und es kann signifikante Unterschiede zwischen Patienten in der Fähigkeit ihres eigenen Serums geben, das Wachstum ihrer eigenen Zellen zu unterstützen (Lange et al., 2007). Alternativ können allogene HS gebündelt werden, was größere Mengen für Laborversuche ergibt und strengen Qualitätstests durch eine Blutbank unterzogen werden kann (z.,, tests auf Abwesenheit von Infektionserregern und Kontamination mit anderen Blutzellen) vor der Anwendung beim Menschen (Bieback et al., 2009).
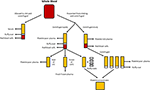
Abbildung 1. Produktion der verschiedenen menschlichen Alternativen. Serum wird produziert, wenn Vollblut gerinnen und zentrifugieren darf, um rote und weiße Blutkörperchen und Blutplättchen zu pelletieren. Plasma wird durch die Verhinderung der Gerinnung gefolgt von Zentrifugation produziert., Abhängig von der Zentrifugationsgeschwindigkeit wird entweder blutplättchenarmes Plasma (PPP; schnelle Zentrifugation) oder blutplättchenreiches Plasma (PRP; langsamere Zentrifugation) erzeugt. Wenn das PPP bei -18°C gelagert wird, wird es als frisch gefrorenes Plasma bezeichnet. Thrombozytenkonzentrate können entweder hergestellt werden, indem das thrombozytenarme Plasma und die 4 Buffy-Schichten entnommen und zusammengefügt oder mehrere PRPS zentrifugiert und die Thrombozytenpellets (in einer kleinen Menge Plasma suspendiert) zusammengefügt werden.,
Plasma
Plasma ist der nicht-zelluläre flüssige Teil des Blutes, der Wasser, Elektrolyte und Proteine (Gerinnungsfaktoren, Fibrinogen und Antikoagulanzien) enthält. Thrombozytenarmes Plasma (PPP), frisch gefrorenes Plasma (FFP) und thrombozytenreiches Plasma (PRP; Abbildung 1) können aus Vollblut durch Zentrifugation mit unterschiedlichen Geschwindigkeiten und anschließende Lagerung bei unterschiedlichen Temperaturen gewonnen werden. Die GF-Sekretion kann durch Aktivierung der Blutplättchen im Vollblut mit Thrombin vor der Zentrifugation verstärkt werden (Doucet et al., 2005; Kocoemer et al.,, 2007), wodurch die Aktivität der Plasmaprodukte erhöht wird.
Blutplättchenarmes Plasma
PPP ist nahezu blutplättchenfrei und wird durch Zugabe eines Antikoagulans während des Entnahmevorgangs aus Vollblut hergestellt, wonach das Plasma durch schnelle Zentrifugation abgetrennt wird (Abbildung 1; Koellensperger et al., 2006). Dadurch können die Blutplättchen und roten Blutkörperchen pelletiert werden. Das resultierende PPP wird bei 4°C gelagert und als frisches Plasma bezeichnet., PDGF wird von den aggregierenden Blutplättchen sezerniert; Jedoch wird vernachlässigbares PDGF in PPP infolge der geringen Anzahl von Restplättchen freigesetzt. GFs muss daher möglicherweise zu PPP hinzugefügt werden, wenn es in Medien verwendet wird, wie dies bei der Verwendung von SF Medium der Fall ist (Müller et al., 2006; Gottipamula et al., 2013). Die Verwendung von PPP ohne Zugabe von GFs hat im Vergleich zu HS und FBS zu niedrigeren Proliferationsraten und einem geringeren Anstieg der DNA-Synthese geführt, gemessen unter Verwendung von Thymidineinbau (Vogel et al., 1980; Koellensperger et al., 2006)., PPP mit zusätzlichem GFs führte zu erhöhten Proliferationsraten im Vergleich zu HS (Koellensperger et al., 2006); Diese Unterschiede könnten sich jedoch aus verschiedenen Produktionsprotokollen von PPP und der Zugabe unterschiedlicher GFS-Spiegel zu jedem der PPP-Präparate in dieser Studie ergeben haben. Die Expansion von ASCs in PPP führt zu einer verbesserten Proliferation im Vergleich zu FBS und weist eine osteogene Differenzierung auf, die mit der von ASCs vergleichbar ist, die in HS expandierten (Koellensperger et al., 2014)., Die chondrogene Differenzierung war bei ASCs, die in PPP expandierten, im Vergleich zu ASCs, die in PRP expandierten, verringert (Koellensperger et al., 2014).
Frisch gefrorenes Plasma
FFP wird auf die gleiche Weise wie PPP erhalten, aber es wird direkt nach der Trennung bei -18°C eingefroren (O ‚ Shaughnessy et al., 2004; Liumbruno et al., 2009). FFP wurde beim Ausbau von BM-MSCs mit positiven Ergebnissen eingesetzt., Diese Ergebnisse umfassen eine bessere Proliferation, immunsuppressive Aktivität und Differenzierung in Adipozyten und Osteozyten.und ein Immunphänotyp und eine Morphologie, die mit Zellen vergleichbar sind, die in FBS expandierten (Müller et al., 2006; Mannello und Tonti, 2007). Die Verwendung von FFP als Serumersatz bei der ASC-Erweiterung erfordert jedoch weitere Untersuchungen.
blutplättchenreiches Plasma
PRP ist der Blutanteil, der mit Blutplättchen angereichert ist. PRP wird hergestellt, indem Plasma von roten Blutkörperchen mit langsameren Zentrifugationsgeschwindigkeiten getrennt wird, was die Pelletierung der Blutplättchen verhindert (Abbildung 1)., In PRP expandierte ASCs behalten einen klassischen Immunphänotyp und Morphologie bei, und PRP erhöht die Proliferation im Vergleich zu FBS (Kocoemer et al., 2007; Chieregato et al., 2011; Atashi et al., 2015). In PRP expandierte ASCs haben eine verbesserte Differenzierungseffizienz gegenüber adipogenen und osteogenen Linien, während sie im Vergleich zu ASCs, die in FBS expandierten, eine vergleichbare Effizienz für die chondrogene Differenzierung aufweisen (Kocoemer et al., 2007; Chieregato et al., 2011). Im Vergleich dazu war HS hinsichtlich der Differenzierung und Proliferation von ASCs etwas besser als PRP (Kocoemer et al.,, 2007; Chieregato et al., 2011). PRP ist aufgrund seiner hohen biologischen Variabilität und seines komplizierten Extraktionsverfahrens ein schlecht definiertes Kulturmediumsergänzungsmittel, bei dem die Reinigung des plättchenfaktorreichen Überstands aus Plasmamembranen schwierig sein kann. Die Verwendung von PRP ist durch die großen Mengen an Vollblut begrenzt, die benötigt werden, um genügend PRP für Experimente zu liefern (Chieregato et al., 2011).,
Blutplättchenlysat
Menschliches Blutplättchenlysat (HPL) enthält Blutplättchen-GFs, die durch Lysieren von Blutplättchen in einem kleinen Plasmavolumen (Blutplättchenkonzentrate; Abbildung 1) durch Temperaturschock erhalten werden. HPL enthält eine höhere Konzentration an GFs als andere Serumersatzstoffe, einschließlich menschlicher PRP und FBS (Doucet et al., 2005; Bernardo et al., 2006, 2011; Bieback et al., 2009; Schallmoser et al., 2010)., HPL kann leicht aus Aphereseprodukten und Buffy Coats gewonnen und hergestellt werden und kann entweder in PRP oder in einer additiven Lösung resuspendiert werden (Schallmoser und Strunk, 2013; Iudicone et al., 2014). HPL wird durch Einfrieren von Blutplättchen bei -30 bis -80°C für 24 h hergestellt, gefolgt von einem Auftau-und Zentrifugationsschritt. Die wiederholten Gefrier -, Tauwetter-und Zentrifugenzyklen ermöglichen die Freisetzung von GFs und die Entfernung von Thrombozytenkörpern (Bernardo et al., 2006; Schallmoser et al., 2007)., Ein weiterer Vorteil der HPL-Supplementierung besteht darin, dass Blutplättchen nach dem 4-5-tägigen Verfallsdatum von Banked Blood verwendet werden können (Bieback et al., 2009). HPL ist eine bessere Alternative als autologes und allogenes HS, da in HPL expandierte ASCs ihren klassischen Immunphänotyp, Differenzierung, klonogene Effizienz, Zellreinheit und Zelllebensfähigkeit beibehalten (Trojahn Kølle et al., 2013; Riis et al., 2016). HPL unterstützt auch eine langfristige Expansion, ohne die immunmodulatorischen Eigenschaften von ASCs zu beeinträchtigen, gemessen durch durchflusszytometrische Analyse (Bieback et al., 2009)., Die Expansion in HPL führt zu einer kürzeren Populationsverdopplungszeit, wodurch die für die Zellexpansion erforderliche Zeit verkürzt und die Gefahr von Seneszenz und Transformation verringert wird (Doucet et al., 2005; Shahdadfar et al., 2005; Bernardo et al., 2006, 2011; Azouna et al., 2012). Die Biosicherheit von HPL wurde unter Verwendung einer vergleichenden genomischen Hybridisierung und einer spektralen Karyotypisierung mit hoher Empfindlichkeit bewertet, wobei festgestellt wurde, dass in HPL expandierte ASCs keine Chromosomenaberrationen aufwiesen (Crespo-diaz et al., 2011; Trojahn Kølle et al., 2013)., Die klassische ASC-Morphologie (dünn, kleiner, länglich und spindelförmig) wird in HS und HPL beibehalten, während in FBS expandierte ASCS größer und weniger spindelförmig sind (Trojahn Kølle et al., 2013). Obwohl dies darauf hindeuten kann, dass sowohl HS als auch HPL für primitive/unreife ASCs auswählen (Doucet et al., 2005; Bieback et al., 2009), es deutet auch darauf hin, dass in FBS gezüchtete Zellen die Proliferation verringert haben und schneller in Richtung Seneszenz voranschreiten. HPL variiert zwischen Individuen (Bernardo et al., 2006; Crespo-diaz et al., 2011), und die Batch-to-Batch-Variation wird reduziert, wenn HPL gebündelt wird (Schallmoser et al.,, 2007; Trojahn Kølle et al., 2013). Darüber hinaus kann durch die Bündelung vieler Spender eine große Menge zur Supplementierung erhalten werden, wodurch HPL PRP vorzuziehen ist (Kocoemer et al., 2007; Bieback et al., 2009; Chieregato et al., 2011).
Schlussfolgerung
Nach Riis et al. von allen registrierten klinischen Studien mit erweiterten ASCs, in denen ihre Expansionsbedingungen aufgeführt sind, verwendet die Mehrheit FBS, drei Studien verwenden autologes HS, eine Studie verwendet PRP und eine Studie verwendet HPL (Riis et al., 2015)., Diese Statistiken sind alarmierend, da FBS das Potenzial hat, zoonotische Erkrankungen nach Zelltransplantation zu übertragen, und Immunreaktionen gegen FBS-Komponenten berichtet wurden (Selvaggi et al., 1997; Mackensen et al., 2000). FBS ist ein nicht GMP-konformes Produkt, da es die Sicherheit und Wirksamkeit des ASC-Arzneimittels beeinflusst und daher ersetzt werden muss (van der Valk et al., 2004; Kyllonen et al., 2013; Witzeneder et al., 2013). Dies wurde behoben, indem FBS durch chemisch definierte vom Menschen abgeleitete Alternativen ersetzt wurde., Der Wechsel von FBS zu humanen Alternativen oder XF / SF-Medien in der regenerativen Medizin hat den wichtigen Vorteil, dass sich die ASCs in letzterem viel schneller vermehren, was zu einer größeren Anzahl von Zellen für die Transplantation in kürzerer Zeit führt. Die relative Überlegenheit verschiedener Kulturmedien wird jedoch immer noch weithin diskutiert. Studien, in denen mehr als ein Kulturmedium verglichen wurde, haben unterschiedliche Ergebnisse berichtet (Lange et al., 2007; Bernardo et al., 2011; Koellensperger et al., 2014; Riis et al., 2016). Koellensperger et al., verglichen wurde die dreistufige Differenzierung von ASCS in FBS, PRP, PPP und HS (Koellensperger et al., 2014). Ihre Ergebnisse zeigten, dass jedes Kulturmedium die Differenzierung in eine oder mehrere Linien ermöglichte, aber nie in alle drei Linien. Wenn XF Medien, FBS und HPLC Medien verglichen wurden, Riis et al. es wurde festgestellt, dass bestimmte Subpopulationen spezifische Oberflächenmarker in Abhängigkeit vom verwendeten Kulturmedium exprimierten (Riis et al., 2016)., Studien zum Vergleich des Immunphänotyps von in FBS expandierten ASCS und der anderen Kulturmedien fanden unabhängig von den untersuchten Markern wenig bis keinen Unterschied in der Zelloberflächenmarkerexpression (Tabelle 1). Aussaatdichte, Sauerstoffspannung, Konfluenz, Dissoziation und die Wahl der basalen Medien können ebenfalls die experimentellen Ergebnisse beeinflussen (Sotiropoulou et al., 2006; Freshney, 2010; Bourin et al., 2013; Inamdar und Inamdar, 2013; Feng et al., 2014; Riis et al., 2015)., Die Wahl des Kulturmediums hängt von der nachgeschalteten Anwendung dieser Zellen (Verabreichung von differenzierten oder nicht differenzierten ASCs) und dem zu behandelnden Zustand ab. Darüber hinaus sollte die Immunogenität des zur Erweiterung der Zellen vor der klinischen Anwendung verwendeten Kulturmediums als Parameter betrachtet werden, der das klinische Ergebnis beeinflussen kann. Die meisten Studien zum Vergleich verschiedener Kulturmedien verwendeten die vom ISCT und IFATS festgelegten Kriterien, um die Verwendung einer Alternative zu FBS zu validieren., Die meisten dieser Studien untersuchen ASC-Morphologie, Proliferation, Immunphänotyp und die Fähigkeit dieser Zellen, sich entlang osteogener, chondrogener und adipogener Linien in verschiedenen Kulturmedien zu differenzieren. Nur wenige Studien haben andere Aspekte von ASCs untersucht, wie Seneszenz, genetische Stabilität, Transkriptom, Proteom, Immunogenität, Zytokinsekretion und Zellzyklus (Shahdadfar et al., 2005; Bieback et al., 2012). Während die ISCT-und IFATS-Kriterien ein Versuch waren, das Feld in Bezug auf Standardbetriebsverfahren zu vereinheitlichen (Dominici et al., 2006; Bourin et al.,, 2013) besteht kein Konsens darüber, welche Eigenschaften von ASCs für klinische Studien relevant sind, was den Vergleich verschiedener Kulturmedien praktisch unmöglich macht. Während diese Kriterien messbare Ergebnisse für einen einfachen Vergleich liefern, können wechselnde Komponenten, die für die Erweiterung von ASCs verwendet werden, unterschiedliche Auswirkungen auf die Sicherheit, Wirksamkeit und Reproduzierbarkeit von ASC-Endprodukten haben. Die Untersuchung von Veränderungen im Transkriptom, Proteom und Sekretom von ASCs, die in verschiedenen Kulturmedien expandierten, ist ebenso wichtig wie die Verwendung von Zellen, die unter unterschiedlichen Bedingungen in geeigneten präklinischen Modellen expandierten.,

Tabelle 1. Die Auswirkungen der verschiedenen Medienpräparate auf ASCs in vitro.
Autorenbeiträge
CD konzipierte und entwarf die Rezension und genehmigte das endgültige Manuskript. MP assistierte bei der Konzeption der Überprüfung, überarbeitete und genehmigte das endgültige Manuskript. MSP unterstützte bei der Konzeption der Überprüfung, bearbeitete und genehmigte das endgültige Manuskript und erhöhte die Mittel für die betroffenen Projekte. Alle Autoren haben das endgültige Manuskript gelesen und genehmigt.,
Finanzierung
Diese Forschung und deren Veröffentlichung ist das Ergebnis einer Finanzierung durch den Medical Research Council of South Africa im Rahmen des (a) Flagships Awards Project SAMRC-RFA-UFSP des MRC-01-2013/STAMMZELLEN sowie (b) die extramurale Einheit für Stammzellforschung und-therapie. Der National Research Foundation of South Africa auch Mittel zur Verfügung gestellt.
Interessenkonflikterklärung
Die Autoren erklären, dass die Untersuchung ohne kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.,
Danksagungen
Die Autoren danken Dr. Cheryl Tosh für ihre redaktionelle Unterstützung.
Chieregato, K., Castegnaro, S., Madeo, D., Astori, G., Pegoraro, M., und Rodeghiero, F. (2011). Epidermaler Wachstumsfaktor, basischer Fibroblastenwachstumsfaktor und von Thrombozyten abgeleiteter Wachstumsfaktor-bb können fetales Rinderserum ersetzen und mit menschlichem thrombozytenreichem Plasma bei der ex-vivo-Expansion mesenchymaler Stromazellen aus Fettgewebe konkurrieren. Cytotherapy 13, 933-943. doi: 10.3109/14653249.2011.,583232
PubMed Abstract | CrossRef Full Text | Google Scholar
Mannello, F., und Tonti, G. (2007). Prägnante Übersicht: Keine Durchbrüche für die menschliche Mesenchym-und embryonale Stammzellkultur: konditioniertes Medium, Feederschicht oder Feeder-frei; Medium mit fetalem Kalbsserum, menschlichem Serum oder angereichertem Plasma; serumfreies, nicht konditioniertes Serumersatzmedium oder Ad-hoc-Formel? alles, was glänzt ist nicht gold! Stammzellen 25, 1603-1609. doi: 10.1634/stemcells.2007-0127
PubMed Abstract | CrossRef Full Text | Google Scholar
Selvaggi, T. A., Walker, R. E.,, und Fleisher, T. A. (1997). Entwicklung von Antikörpern gegen fetales Kalbsserum mit arthusähnlichen Reaktionen bei mit humanen Immunschwächevirus infizierten Patienten mit syngenen Lymphozyteninfusionen. Blut 89, 776-779.
PubMed Abstract | Google Scholar
Stedman, T. L. (2006). Stedmans medizinisches Wörterbuch. Philadelphia, PA: Lippincott Williams & Wilkins.
Google Scholar