az alumínium kémiai elem más fémnek minősül. Az 1750-es években fedezte fel Andreas Marggraf.,

Data Zone
| Classification: | Aluminum is an ‘other metal’ |
| Color: | silvery |
| Atomic weight: | 26.98154 g/mol |
| State: | solid |
| Melting point: | 660.32 oC, 933.57 K |
| Boiling point: | 2466.85 oC, 2740.,00 K |
| Electrons: | 13 |
| Protons: | 13 |
| Neutrons in most abundant isotope: | 14 |
| Electron shells: | 2,8,3 |
| Electron configuration: | 1s2 2s2 2p6 3s2 3p1 |
| Density @ 20oC: | 2.702 g/cm3 |
Show more, including: Heats, Energies, Oxidation,
Reactions, Compounds, Radii, Conductivities
| Atomic volume: | 9.,98 cm3/mol | ||
| Structure: | fcc: face-centered cubic | ||
| Hardness: | 2.8 mohs | ||
| Specific heat capacity | 0.90 J g-1 K-1 | ||
| Heat of fusion | 10.790 kJ mol-1 | ||
| Heat of atomization | 326 kJ mol-1 | ||
| Heat of vaporization | 293.40 kJ mol-1 | ||
| 1st ionization energy | 577.6 kJ mol-1 | ||
| 2nd ionization energy | 1816.6 kJ mol-1 | ||
| 3rd ionization energy | 2744.,7 kJ mol-1 | ||
| Electron affinity | 42.6 kJ mol-1 | ||
| Minimum oxidation number | 0 | ||
| Min. common oxidation no. | 0 | ||
| Maximum oxidation number | 3 | ||
| Max. common oxidation no. | 3 | ||
| Electronegativity (Pauling Scale) | 1.61 | ||
| Polarizability volume | 8.,> | Reaction with 15 M HNO3 | passivated |
| Reaction with 6 M HCl | mild, ⇒ H2, AlCl3 | ||
| Reaction with 6 M NaOH | mild, ⇒ H2, – | ||
| Oxide(s) | Al2O3 | ||
| Hydride(s) | AlH3 | ||
| Chloride(s) | AlCl3 & Al2Cl6 | ||
| Atomic radius | 125 pm | ||
| Ionic radius (1+ ion) | – | ||
| Ionic radius (2+ ion) | – | ||
| Ionic radius (3+ ion) | 53.,5 pm | ||
| Ionic radius (1- ion) | – | ||
| Ionic radius (2- ion) | – | ||
| Ionic radius (3- ion) | – | ||
| Thermal conductivity | 237 W m-1 K-1 | ||
| Electrical conductivity | 37.6676 x 106 S m-1 | ||
| Freezing/Melting point: | 660.32 oC, 933.,57 K |
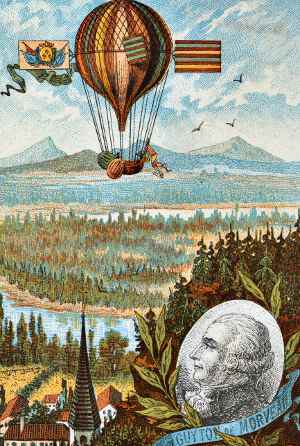
Louis de Morveau úgy vélte, hogy egy új fém felfedezhető az oxid alumínium-oxidban. Igaza volt, de nem tudta elkülöníteni. De Morveau kidolgozta a vegyi anyagok elnevezésének első módszerét, és mint látjuk, úttörő balloonista volt.,
Aluminum’s Periodic Table
Neighborhood
| Group 2 or 12 |
Group 13 |
Group 14 |
|
| 2 | 4 Be |
5 B |
6 C |
| 3 | 12 Mg |
13 Al |
14 Si |
| 4 | 30 Zn |
31 Ga |
32 Ge |
Discovery of Aluminum
az emberek ősidők óta használnak alumot festésre, barnításra és a vérzés megállítására. Az Alum kálium-alumínium-szulfát.
az 1750-es években Andreas Marggraf német kémikus úgy találta, hogy alkáli oldatot használhat az alum új anyagának kicsapására. Marggraf 1746-ban elsőként izolálta a cinket.
az alumíniumból nyert Marggraf anyagot Louis de Morveau francia kémikus alumínium-oxidnak nevezte 1760-ban. Most már tudjuk, hogy a timföld alumínium-oxid-kémiai képlet Al2O3.,
de Morveau úgy vélte, hogy az alumínium-oxid tartalmaz egy új fémelemet, de Marggrafhoz hasonlóan nem tudta kivonni ezt a fémet az oxidjából. (1), (2)
1807-ben vagy 1808-ban Humphry Davy angol kémikus elektromos ívben lebontotta az alumínium-oxidot, hogy fémet kapjon. A fém nem tiszta alumínium volt, hanem alumínium és vas ötvözet.
Davy az új fém alumiumot hívta, majd átnevezte alumíniumnak. (3)
az alumíniumot először 1825-ben izolálta Hans Christian Ørsted (Oersted) Koppenhágában, Dániában, aki arról számolt be, hogy “egy darab fém, amely színes és csillogás kissé hasonlít az ónra.,”
Ørsted előállított alumínium redukálásával alumínium-klorid segítségével kálium-higany amalgám. A higanyt melegítéssel távolították el, hogy elhagyja az alumíniumot.
Friedrich Wöhler (Woehler) német kémikus megismételte Ørsted kísérletét, de úgy találta, hogy csak kálium-fémet eredményezett. Wöhler két évvel később továbbfejlesztette a módszert, reagálva a volatalizált alumínium-trikloridot káliummal kis mennyiségű alumínium előállítására. (1)
1856-ban Berzelius kijelentette, hogy Wöhler volt az, aki 1827-ben sikerrel járt. Wöhler ezért általában hitelt kap a felfedezésért.,
újabban Fogh megismételte az eredeti kísérleteket, és kimutatta, hogy Ørsted módszere kielégítő eredményeket adhat.
Ez megerősítette Ørsted eredeti munkájának prioritását és az alumínium felfedezőjeként betöltött pozícióját. (4)
majdnem három évtizeden keresztül az alumínium újdonság maradt, drága gyártani és értékesebb, mint az arany, amíg 1854-ben Henri Saint-Claire Deville Párizsban, Franciaországban megtalálta a módját, hogy a káliumot sokkal olcsóbb nátriummal helyettesítse az alumínium izolálására., Az alumínium ezután egyre népszerűbb lett, de mivel még mindig meglehetősen drága volt, inkább díszítő, mint gyakorlati helyzetekben használták.
végül 1886-ban Charles Martin Hall amerikai kémikus és Paul Héroult francia kémikus önállóan feltalálták a Hall-Héroult folyamatot, amely olcsón izolálja az alumínium fémet oxidjából elektrolitikusan.
az alumíniumot ma is a Hall-Héroult eljárással gyártják.
érdekes tények az alumíniumról
- az alumíniumgyártás sok energiát igényel – 17.,4 megawatt órányi elektromos energia egy metrikus tonna alumínium előállításához; ez háromszor annyi energiát jelent, mint amennyi egy metrikus tonna acél előállításához szükséges. (5)
- az alumínium nagyszerű fém az újrahasznosításhoz. Az újrahasznosítás az alumínium előállításához szükséges energia mindössze 5% – át használja fel ércéből, bauxitból. (6)
- az alumínium normál körülmények között nem tapad a mágnesekhez.
- a földkéregben több alumínium van, mint bármely más fém. Körülbelül 8 százaléknál az alumínium a bolygónk kéregének harmadik legelterjedtebb eleme, az oxigén és a szilícium mögött.,
- nagy bősége ellenére az 1850-es években az alumínium értékesebb volt, mint az arany. 1852-ben az alumínium ára 1200 dollár / kg, az arany 664 dollár / kg volt.
- az Alumíniumárak szemléltetik a pénzügyi spekuláció veszélyeit: 1854-ben Saint-Claire Deville megtalálta a módját, hogy a káliumot sokkal olcsóbb nátriummal helyettesítse az alumínium izolálására. 1859-re az alumínium ára 37 dollár / kg volt, ára mindössze öt év alatt 97% – kal csökkent.,
- ahol az előző tétel kiemeli a spekuláció veszélyeit, ez a tétel kiemeli a kémia egyik diadalát: a Hall-Heroult elektrolitikus folyamatot 1886-ban fedezték fel. 1895-re az alumínium ára mindössze 1, 20 dollárra esett kilogrammonként.
- A Rubin drágakövek elsősorban alumínium-oxidok, amelyekben az alumíniumionok kis részét krómionok váltották fel.
- az alumínium nehéz csillagok nukleáris tüzében készül, amikor egy proton hozzáadja a magnéziumot. (A magnéziumot csillagokban készítik két szén magfúziójával.,) (7)

A Genesis űrhajó alumínium kollektorja. Az alumínium gyorsan mozgó nemesgáz fajokat halmozott fel a napszélből; ezek a fajok behatoltak és beragadtak a fémbe., Az űrhajó visszatért a földre, és a nemesgázokat elemezték, hogy megismerjék a Naprendszer eredetét. Kép: NASA/JSC.

olvadt alumínium öntése.
megjelenés és jellemzők
káros hatások:
nincs bizonyított probléma; a lenyelés alzheimer-kórt okozhat
jellemzők:
Az alumínium ezüstfehér fém., Nem tapad a mágnesekhez (paramágneses, ezért normál körülmények között mágnesessége nagyon, nagyon gyenge). Ez egy kiváló elektromos vezető. Alacsony sűrűségű és nagy hajlékonyságú. Túl reaktív ahhoz, hogy általában fémként találják meg, bár nagyon ritkán megtalálható a natív fém. (8)
Az alumínium megjelenése elmosódott, reakcióképességét egy alumínium-oxid film passziválja, amely normál körülmények között természetesen a fém felületén képződik. Az oxidfilm olyan anyagot eredményez, amely ellenáll a korróziónak., A film lehet megvastagodott elektrolízissel vagy oxidálószerek, alumínium ebben a formában fog ellenállni támadás híg savak, híg lúgok, koncentrált salétromsav.
Alumínium fekszik kellően messze a jobb oldalon, a periódusos rendszer, ami azt mutatja, néhány tanácsot a nonmetal viselkedés, reagál a forró lúgok, hogy formában aluminát ionok–, valamint a több tipikus fém reakciója savakkal, hogy kiadja a hidrogén gáz -, illetve alkotják a pozitív töltésű fém ion, Al3+. az alumínium amfoter.
A tiszta alumínium meglehetősen puha, szilárdsága hiányzik., A kereskedelmi alkalmazásokban használt alumínium kis mennyiségű szilíciumot és vasat (kevesebb, mint 1%) ad hozzá, ami jelentősen megnöveli a szilárdságot és a keménységet.
alumínium felhasználása
alacsony sűrűsége, alacsony költsége és korrózióállósága miatt az alumíniumot széles körben használják szerte a világon.
it is used in an extensive range of products from italos kannák to window frames and boats to aircraft. A Boeing 747-400 147 000 font (66 150 kg) nagy szilárdságú alumíniumot tartalmaz.
ellentétben néhány fémmel, az alumíniumnak nincs aromája – ezért széles körben használják az élelmiszercsomagolásban és a főzőedényekben.,
bár nem olyan jó, mint ezüst vagy réz, az alumínium kiváló elektromos vezető. Ezek a fémek is lényegesen olcsóbbak és könnyebbek, ezért széles körben használják a felsővezetékekben.
az összes fém közül csak a vasat használják szélesebb körben, mint az alumínium.
bőség és izotópok
bőség földkéreg: 8,23 tömegszázalék, 6,32% MOL
bőség naprendszer: 56 ppm tömeg, 2,7 ppm MOL
költség, tiszta: $ 15,72 per 100g
költség, ömlesztett: $ 0 .,20 per 100g
Forrás: alumínium a legelterjedtebb fém a földkéregben, és a földkéreg harmadik legtöbb eleme, oxigén és szilícium után. Az alumínium túl reaktív ahhoz, hogy tiszta legyen. A bauxit (főleg alumínium-oxid) a legfontosabb érc.
izotópok: 15, amelynek felezési ideje ismert, tömegszáma 22-35. Ezek közül csak kettő fordul elő természetesen: 27al, amely stabil, 26Al, ami radioaktív, felezési ideje 7,17 x 105 év. A 26al-t az argon kozmikus sugárzású bombázása alkotja a Föld légkörében.,

Idézni ezt az Oldalt
Az online összekapcsolása, kérem másolja be az alábbi lehetőségek közül:
<a href="https://www.chemicool.com/elements/aluminum.html">Aluminum</a>
vagy
<a href="https://www.chemicool.com/elements/aluminum.html">Aluminum Element Facts</a>
cite ez az oldal egy tudományos dokumentum, kérjük, használja a következő KÉPVISELŐ-kompatibilis idézet:
"Aluminum." Chemicool Periodic Table. Chemicool.com. 26 Jul. 2014. Web. <https://www.chemicool.com/elements/aluminum.html>.