Elektron Konfiguráció
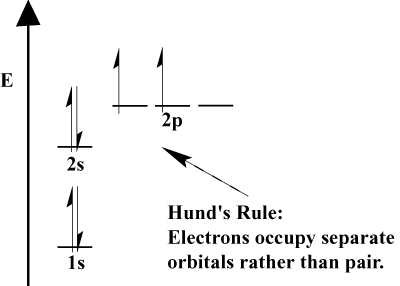
Az elektronok egy atom töltse fel az atomic elektronpályák szerint az Aufbau Elve; “Aufbau,” a német, azt jelenti, hogy “kiépítése.”Az Aufbau Elv, amely magában foglalja a Pauli Kizárási Elv {Hund} Szabálya előírja, néhány egyszerű szabályt kell megállapítani a sorrendet, amelyben az elektronok töltse atomi elektronpályák:
- az Elektronok mindig töltse elektronpályák az alacsonyabb energia először. Az 1s-t 2s előtt, a 2s-t pedig 2p előtt kell kitölteni.,
- A Pauli kizárási elv kimondja, hogy egy adott atomon belül nincs két elektron azonos kvantumszámmal. A funkcióban ez az elv azt jelenti, hogy ha két elektron ugyanazt az orbitát foglalja el, akkor ellentétes centrifugálással kell rendelkezniük.
- {Hund} Szabálya kimondja, hogy ha egy elektron csatlakozik egy atom van, hogy válasszanak a két vagy több elektronpályák az azonos energia, az elektron inkább adjon meg egy üres orbitális inkább, mint egy már foglalt., Mivel több elektront adnak az atomhoz,ezek az elektronok hajlamosak ugyanannak az energiának a félig kitöltésére, mielőtt a meglévő elektronokkal párosítanák a pályákat.
Valenciás és Valenciás elektronok
egy atom legkülső orbitális héját valenciahéjnak nevezik, a valenciahéjban lévő elektronok pedig valenciaelektronok. A Valence elektronok az atom legmagasabb energiájú elektronjai, ezért a leginkább reaktív elektronok. Míg a belső elektronok (azoknak, akik nem a valence shell) jellemzően nem vesznek részt a kémiai kötés, reakciók, valence elektronok is nyert, elvesztette, vagy a megosztott formában kémiai kötések., Emiatt az azonos számú valenciaelektronokkal rendelkező elemek hasonló kémiai tulajdonságokkal rendelkeznek, mivel ugyanúgy hajlamosak a valenciaelektronok megszerzésére, elvesztésére vagy megosztására. A periódusos rendszert ezt a funkciót szem előtt tartva tervezték. Minden elemnek számos valence elektronja van, amely megegyezik a Periódusos táblázat csoportszámával.
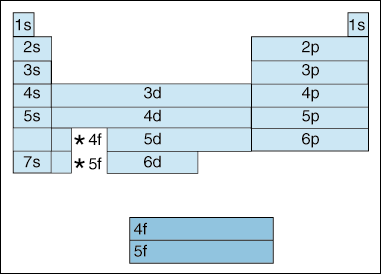
ez a táblázat az elektron konfigurációjának számos érdekes és komplikáló tulajdonságát szemlélteti.,
először is, mivel az elektronok egyre nagyobb energiává válnak, eltolódás történik. Eddig azt mondtuk, hogy a kvantumszám elveként növekszik, így az orbitális energiaszintje is. Amint azt az Aufbau-elvben már említettük, az elektronok alacsonyabb energiájú pályákat töltenek be, mielőtt magasabb energiájú pályákat töltenének be. A fenti ábra azonban egyértelműen azt mutatja, hogy a 4S orbitális a 3D orbitális előtt van kitöltve., Más szóval, ha elérjük az elv kvantum száma 3, a legmagasabb subshells az alsó kvantum számok napfogyatkozás az energia a legalacsonyabb subshells a magasabb kvantum számok: 3d nagyobb energia, mint a 4s.
Második, a fentiek azt a módszert írja le, hogy egy elem szerint az elektron konfiguráció. Ahogy mozog balról jobbra az egész periódusos rendszer, a fenti ábra azt a sorrendet mutatja, amelyben pályák vannak töltve. Ha mi voltunk a ténylegesen lebontják a fenti diagram csoportokra, nem pedig a blokkok van, azt mutatják, hogy pontosan hány elektron minden elem., Például a hidrogén elemét, amely a periódusos rendszer bal felső sarkában található, 1S1-ként írják le, az S leírja, hogy melyik orbitális tartalmaz elektronokat, az 1 pedig leírja, hogy hány elektron van az orbitumban. A lítium, amely a periódusos rendszerben található, közvetlenül a hidrogén alatt, 1s22s1-ként írható le. Az első tíz elem elektronkonfigurációit az alábbiakban mutatjuk be (vegye figyelembe, hogy a vegyértékű elektronok a legmagasabb energiahéjban lévő elektronok, nem csak a legmagasabb energiájú alhéjban lévő elektronok).,

az oktet-szabály
a vegyértékelektron-konfigurációk megvitatása a kémiai kötés egyik alapvető tételéhez, az oktet-szabályhoz vezet. Az oktet szabály kimondja, hogy az atomok válnakkülönösen stabil, amikor a valenciahéjak teljes mértékben kiegészítik a valence elektronokat. Például, a fenti, hélium (He), Neon (Ne) van külső valenciahéjak, amelyek teljesen tele, így sem a tendencia, hogy megszerezzék vagy elveszítik elektronok., Ezért a hélium és a Neon, az úgynevezett nemesgázok közül kettő szabad atomformában létezik, és általában nem képeznek kémiai kötéseket más atomokkal.
A legtöbb elemnek azonban nincs teljes külső héja, és túl instabilak ahhoz, hogy szabad atomként létezzenek. Ehelyett arra törekszenek, hogy kitöltsék külső elektronhéjaikat, kémiai kötéseket képezve más atomokkal, ezáltal nemesgáz-konfigurációt érjenek el. Egy elem általában a legrövidebb utat választja a nemesgáz konfigurációjának eléréséhez, függetlenül attól, hogy ez egy elektron megszerzését vagy elvesztését jelenti-e., Például a nátrium (Na), amelynek egyetlen elektronja van a külső 3S orbitális pályájában, elveszítheti azt az elektronot, hogy elérje a neon elektronkonfigurációját. A klór, hét vegyértékű elektronnal, egy elektront nyerhet az argon konfigurációjának eléréséhez. Ha két különböző elem azonos elektronkonfigurációval rendelkezik, akkor izoelektronikusnak nevezik őket.
Diamagnetism and Paramagnetism
az atom elektronkonfigurációjának következményei vannak a mágneses mezőkkel kapcsolatos viselkedésére is. Az ilyen viselkedés függ az atom azon elektronjainak számától, amelyek spin párosítva vannak., Ne feledje, hogy {Hund} Szabálya, valamint a Pauli Kizárási Elv össze diktálja, hogy egy atom elektronpályák minden fél kitöltés megkezdése előtt, hogy teljesen kitöltse, miközben teljesen kitölti a két elektronok a két elektronok lesz ellenkezője forog.
egy atom, amelynek minden pályája tele van, ezért az összes elektronját ellentétes spin elektronjával párosítva, a mágneses mezők nagyon kevéssé befolyásolják. Az ilyen atomokat diagmetikusnak nevezik. Ezzel szemben a paramágneses atomok nem rendelkeznek az összes elektronjukkal spin-párosítva, és a mágneses mezők befolyásolják őket., Vannak fokú paramagnetizmus, mivel egy atom lehet egy páratlan elektron, vagy lehet, hogy négy.