hogyan működik a puffer?
a puffer képes ellenállni a pH változásnak, mivel a két komponens (konjugált sav és konjugált bázis) egyensúlyi állapotban egyaránt jelentős mennyiségben van jelen, és képes kis mennyiségű más savat és bázist semlegesíteni (H3O+ és OH-formájában), amikor az oldatot hozzáadjuk. Ennek a hatásnak a tisztázása érdekében megfontolhatjuk a hidrogén-fluorid (HF) és a nátrium-fluorid (Naf) puffer egyszerű példáját., A hidrofluorsav gyenge sav a viszonylag kis F – ion és a szolvált protonok (H3O+) közötti erős vonzódás miatt, amely nem teszi lehetővé, hogy vízben teljesen disszociáljon. Ezért, ha megkapjuk HF vizes oldatban, hozzuk létre a következő egyensúlyi csak enyhe disszociációs (Ka(HF) = 6.6×10-4, erősen kedvez fehérjék):
\
Tudunk majd adjuk hozzá, majd oldódik nátrium-fluorid be az oldatot, majd keverjük össze a két, amíg el nem érjük a kívánt hangerőt, pH-érték, amely azt akarjuk, hogy a puffer., Amikor a nátrium-fluorid vízben oldódik, a reakció befejeződik, így kapjuk:
\
mivel a Na+ egy erős bázis konjugátuma, nincs hatással a puffer pH-jára vagy reaktivitására. A \(NAF\) hozzáadása az oldathoz azonban növeli az F – koncentrációját a pufferoldatban, következésképpen a Le Chatelier elvével a HF kissé kisebb disszociációjához vezet az előző egyensúlyban is. Mind a konjugált sav, \(HF\), mind az F-konjugált bázis jelentős mennyiségének jelenléte lehetővé teszi az oldat pufferként való működését., Ez a pufferhatás a pufferoldat titrálási görbéjében látható.
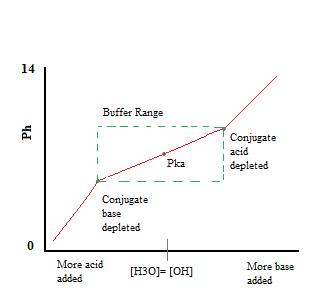
amint láthatjuk, a puffer működési tartományán keresztül. a pH nagyon keveset változik sav vagy bázis hozzáadásával. Ha a pufferelési kapacitás meghaladja a pH-változás sebességét, gyorsan ugrik. Ez azért fordul elő, mert a konjugált savat vagy bázist semlegesítéssel kimerítették. Ez az elv azt jelenti, hogy nagyobb mennyiségű konjugált sav vagy bázis nagyobb pufferelési kapacitással rendelkezik.,
ha savat adunk hozzá:
\
ebben a reakcióban a konjugált bázis, F -, semlegesíti a hozzáadott savat, H3O+, és ez a reakció befejeződik,mert az F-reakció H3O+ – val sokkal nagyobb egyensúlyi állandóval rendelkezik. (Valójában az egyensúlyi állandó az írott reakció csak a Ka inverze a HF-hez: 1/Ka(Hf) = 1/(6, 6×10-4) = 1, 5×10+3.,) Mindaddig, amíg több F -, mint H3O+ van, szinte az összes H3O+ – ot elfogyasztják, és az egyensúly jobbra tolódik, kissé növelve a HF koncentrációját, és kissé csökkentve az F-koncentrációját, de az egyensúly helyreállítása után alig változik a H3O+ mennyisége.,
if base were added:
\
ebben a reakcióban a konjugált sav, HF, semlegesíti a hozzáadott mennyiségű bázist, OH -, és az egyensúly ismét jobbra tolódik, kissé növelve az F – koncentrációját az oldatban, és kissé csökkentve a HF mennyiségét. Ismét, mivel a legtöbb OH-semlegesítik, kis pH változás fog bekövetkezni.
Ez a két reakció továbbra is váltakozhat oda-vissza, kevés pH-változással.