a sav-bázis (proton átutalás) reakció
Az első példa a kémiai reaktivitás, nézzünk egy nagyon egyszerű reakció között-hidroxid-ion sósav:
HCl+Ó^- \működik a legjobban, H_20+Cl^-
Ez egy sav-bázis reakció: egy proton át HCl, a sav, hogy-hidroxid, a bázis. A termék víz (a hidroxid konjugált savja) és kloridion (a HCl konjugált bázisa)., Kétségtelenül látta ezt a reakciót az Általános Kémia előtt. Annak ellenére, hogy az egyszerűség (és annak ellenére, hogy a reagensek és termékek szervetlen helyett szerves), ez a reakció lehetővé teszi számunkra, hogy fontolja meg először sok alapvető elképzelések szerves kémia, hogy mi lesz feltárása különböző kontextusokban az egész szöveget.
bármely reakciómechanizmus megértésének kulcsa az elektronsűrűség fogalma, valamint az, hogy hogyan kapcsolódik az elektron mozgásához (kötés-törés és kötésformálás), amely egy reakcióban fordul elő., A hidroxid-ion-pontosabban a hidroxid-ion elektronegatív oxigénatomja – nagy elektronsűrűséggel rendelkezik a negatív töltés és a hidrogén-oxigén kötés polaritása miatt. A hidroxid oxigén elektronban gazdag.

a HCl-ben lévő hidrogénatom viszont alacsony elektronsűrűséggel rendelkezik: elektronszegény. Ahogy várható, valami, ami elektronban gazdag vonzódik valami, ami elektronszegény., Mint-hidroxid, majd HCl közelebb egymáshoz, egy magányos pár elektronok az elektron-gazdag-hidroxid oxigén vonz az elektron-szegény proton a HCl, elektron mozgása fordul felé a proton. A hidrogén-klór-szigma kötésben lévő két elektront ez a közeledő hidroxid elektronsűrűség taszítja, ezért még távolabb kerül a protontól és a klórmag felé., A következménye mindez elektron mozgása az, hogy a hidrogén-klór bond törve, mint a két elektronok a bond teljesen elszakadni az 1-es pálya a hidrogén lesz egy magányos pár a 3p orbitális egy-klorid-anion.
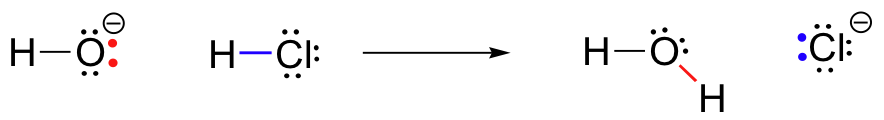
ugyanakkor, hogy a hidrogén-klór kötés megszakad, új sigma kötés alakul ki a hidrogén és az oxigén között, amely tartalmazza a két elektront, amelyek korábban egy magányos pár voltak hidroxidon. Ennek a kötésképződésnek az eredménye természetesen egy vízmolekula.
korábban (6.1 pont.,), láttuk, hogy az íves nyilakkal ábrázolják az elektron mozgását, amely kémiai reakciókban fordul elő, ahol a kötések megszakadnak, és új kötések alakulnak ki. A HCl + OH-reakciót például két ívelt nyíl rajzolásával ábrázolják.
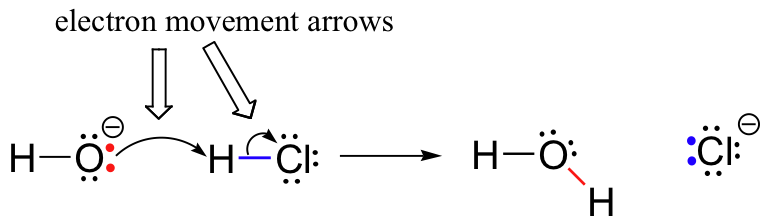
az első nyíl a hidroxid oxigén egyik magányos párjából származik, és a hidrogén-bromid molekula ” H “jelére mutat, szemléltetve az oxigén-magányos pár “támadását” és az új hidrogén-oxigén kötés későbbi kialakulását., A második ívelt nyíl a hidrogén-bróm kötésből származik, és a ” Br “jelre mutat, jelezve, hogy ez a kötés megszakad – a két elektron “távozik”, és magányos párká válik a bromidionon.
nagyon fontos hangsúlyozni ezen a ponton, hogy ezek az ívelt, két szöges nyilak mindig két elektron mozgását képviselik. A könyv nagy részét a kételektron mozgással járó reakciómechanizmusok leírására fordítják, így ezek a teljes fejű nyilak nagyon ismerősek lesznek.,

a második félévben azonban radikális reakciómechanizmusokat fogunk megvizsgálni, ahol egyelektron mozgás történik. Ezekhez a folyamatokhoz egy ívelt, egyágú (“halhorog”) nyíl kerül felhasználásra.
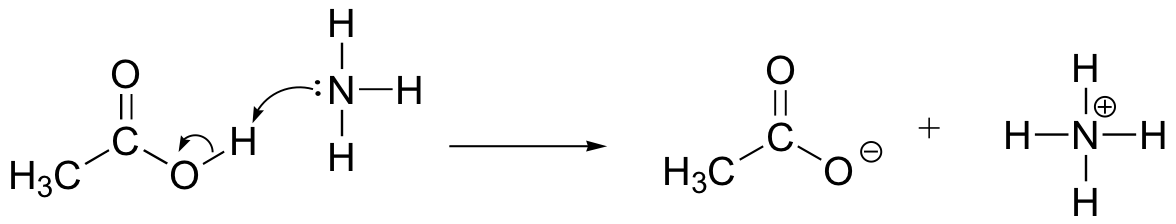
rajzoljon elektronmozgási nyilakat az ecetsav, a CH3COOH és az ammónia közötti sav-bázis reakció szemléltetésére, NH3. Rajzolja ki a reagensek és a termékek teljes szerkezetét.