Wenn Sie gefragt werden, ob die nucleophile Substitution den SN1 – oder SN2-Mechanismus durchläuft, betrachten Sie die folgenden Kriterien in der angegebenen Reihenfolge:
1) Überprüfen Sie das Substrat (Alkylhalogenid am häufigsten): Wenn es sich um ein Primärsubstrat handelt, ist der Mechanismus SN2.

2) Wenn es sich um ein tertiäres Substrat handelt, ist der Mechanismus SN1 – Keine Fragen, Sie sind damit fertig.,

Eine Erinnerung an die Klassifizierung von Substraten als primär -, Sekundär-oder Tertiärsubstrate:

Denken Sie an dieses Reaktivitätsdiagramm der Alkylhalogenide in SN1-und SN2-Substitutionsreaktionen:

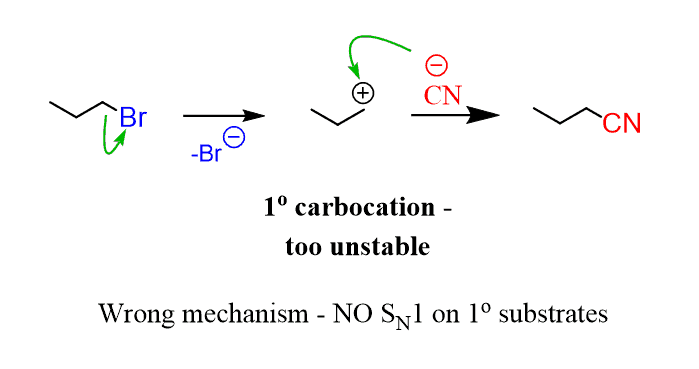
Um das Problem mit diesem Mechanismus zu verstehen, müssen Sie sich daran erinnern, dass primäre Carbokationen sehr instabil sind und unter normalen Umständen einfach nicht gebildet werden., Dieser Mechanismus ist also unmöglich:
Die einzige Möglichkeit, eine Substitution zu erreichen, besteht darin, das nukleophile und das Substrat gleichzeitig in den Geschwindigkeitsbestimmungsschritt einzubeziehen:

Und dies ist per Definition der SN2-Mechanismus.
Warum kann Tertiär SN2 nicht tun?
Nun wollen wir sehen, warum tertiäre Substrate nur SN1-Reaktionen erfahren können. Wenn Sie einen SN2-Mechanismus auf einem tertiären Substrat ausführen würden, müssten Sie das Nukleophile zeigen, das das Substrat angreift, während die verbleibende Gruppe noch vorhanden ist (per Definition des SN2-Mechanismus)., Und noch einmal, lassen Sie uns einen hypothetischen Mechanismus dafür zeichnen:
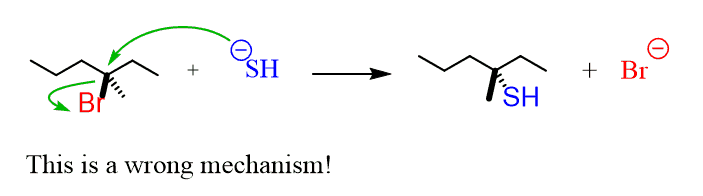
Das Problem hier ist, dass das Nucleophile keinen Platz hat, um auf den Kohlenstoff zuzugreifen, der die Leaving-Gruppe trägt. Dieser Kohlenstoff ist umgeben (sterisch behindert) von den benachbarten Kohlenstoffen, die den Zugang des Nukleophils blockieren:
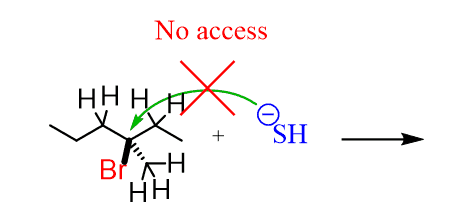
Das Nukleophile muss warten, bis die abgehende Gruppe verschwunden ist und nur dann angreifen kann., Daher wird die Geschwindigkeit des gesamten Prozesses durch den Verlust der Ausscheidungsgruppe bestimmt (verlangsamt), was der geschwindigkeitsbestimmende Schritt im SN1-Mechanismus ist.
Also, zusammenfassend:
Wenn das Substrat primär ist-es ist SN2
Wenn das Substrat tertiär ist-es ist SN1
Was ist mit den sekundären Substraten?
Jetzt das Sekundärsubstrat – der Unruhestifter. Bei Sekundärsubstraten wird der Mechanismus weitgehend durch das Nucleophile bestimmt und das Prinzip hier lautet:
ein starkes Nucleophiles tut SN2, während ein schwaches Nucleophiles SN1 tut.,
In einfachen Worten bedeutet ein starkes Nukleophiles ein reaktives / aggressives / instabiles Nukleophiles, also eines, das eine große Elektronendichte (einsame Paare und insbesondere eine negative Ladung) hat und mit dieser Elektronendichte nicht zufrieden ist. Da es reaktiv ist, wird es nicht darauf warten, dass die ausscheidende Gruppe geht, bevor sie angreift. Es greift an und tritt die folgende Gruppe aus:
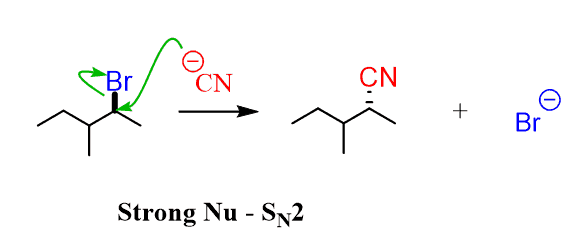
Im Allgemeinen nimmt die Nukleophilie mit der Basizität zu, dh starke Basen sind bessere Nukleophile.,

Es könnte eine gute Idee sein, die Säure-Base-Chemie und das pKa-Konzept zu überarbeiten, um stärkere Basen zu erkennen. Hier sind die häufigsten starken Nukleophilen:

Wenn Sie andererseits ein schwaches Nukleophiles haben, wählen Sie den SN1 als primären Mechanismus für die Reaktion., Schwaches Nucleophil bedeutet, dass es nicht so reaktiv ist und nicht angreift, es sei denn, die Austrittsgruppe ist weg, und es wird eine Carbokation gebildet:
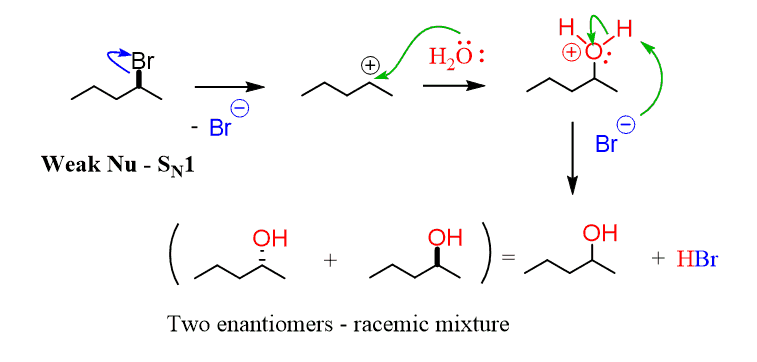
Sobald ein positiv geladener Kohlenstoff in der Lösung vorhanden ist, greift das Nucleophile an, da es trotz seiner Schwäche immer noch eine ausreichende Elektronendichte aufweist, um den stark elektrophilen Kohlenstoff des Substrats anzugreifen.
Die beiden Hauptnukleophilen sind das Wasser und die Alkohole.
Neben dem Nukleophilen spielt das Lösungsmittel auch eine Rolle bei der Bestimmung des Hauptmechanismus bei nukleophilen Substitutionsreaktionen., Hier müssen Sie bedenken, dass polare aprotische Lösungsmittel den SN2-Mechanismus begünstigen, während polare protische Lösungsmittel den SN1-Mechanismus begünstigen.
Diese beiden Lösungsmittelarten sind in der nachstehenden Tabelle aufgeführt.
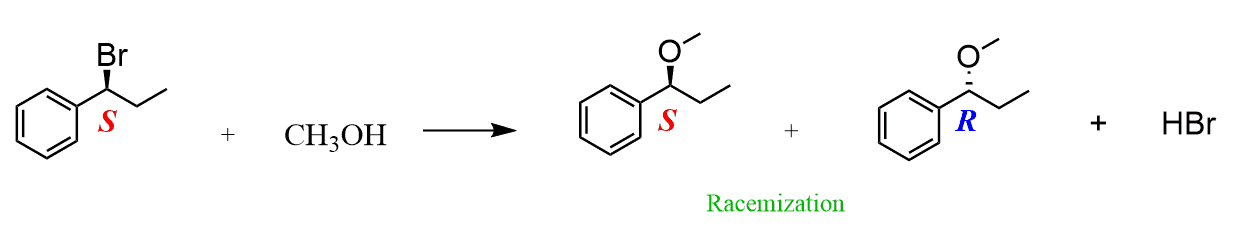
Bestimmen von SN1 oder SN2 basierend auf der Stereochemie des Produkts
In einigen Fällen werden Sie möglicherweise aufgefordert, den Mechanismus basierend auf der Struktur, hauptsächlich der Stereochemie, des Produkts zu bestimmen.,
Zwei wichtige Merkmale, an die Sie sich erinnern müssen:
- Der SN2-Mechanismus durchläuft die Inversion der Konfiguration
- Der SN1-Mechanismus durchläuft die Racemisierung
Hier geht es um die absolute Konfiguration des elektrophilen Kohlenstoffs (der mit der Leaving-Gruppe verbunden ist).
Also, wenn Sie das Produkt als ein Stereoisomer sehen (dh, es wird als Keil oder Bindestrich dargestellt – genauer gesagt ist es entweder R oder S), dann wissen Sie, dass es sich um einen SN2-Mechanismus handeln muss:
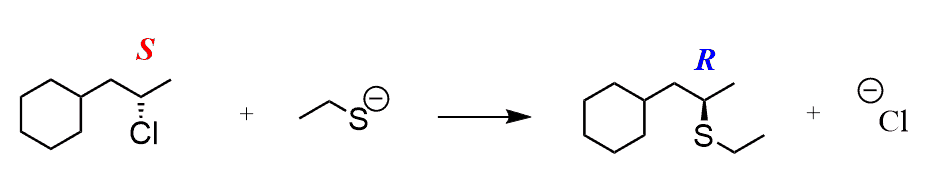
Wenn das Produkt als Mischung aus zwei Stereoisomeren (R und S des elektrophilen Kohlenstoffs) angezeigt wird, muss der Mechanismus SN1 sein: