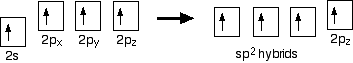Eine einfache Ansicht der doppelten kovalenten Bindungen
Eine doppelte kovalente Bindung ist, wo zwei Paare von Elektronen zwischen den Atomen geteilt werden, anstatt nur ein Paar.
Einige einfache Moleküle mit Doppelbindungen
Sauerstoff, O2
Zwei Sauerstoffatome können beide stabile Strukturen erreichen, indem sie zwei Elektronenpaare wie im Diagramm teilen.
Die Doppelbindung wird konventionell durch zwei Linien dargestellt, die die Atome verbinden. Jede Linie repräsentiert ein Paar gemeinsamer Elektronen.,
Kohlendioxid, CO2
Ethen, C2H4
Ethen hat eine Doppelbindung zwischen den beiden Kohlenstoffatomen.
Eine ausgefeiltere Ansicht der Bindung in Ethen
Es ist wichtig, die Bindung in Ethen genauer zu untersuchen, da sie einen direkten Einfluss auf seine Chemie hat. Es sei denn, Sie haben ein gewisses Verständnis für die wahre Natur der Doppelbindung, Sie können nicht wirklich verstehen, wie sich Ethen verhält.,
Eine Orbitalansicht der Bindung in Ethen
Ethen wird aus Wasserstoffatomen (1s1) und Kohlenstoffatomen (1s22s22px12py1) aufgebaut.
Förderung eines Elektrons
Das Kohlenstoffatom hat nicht genug ungepaarte Elektronen, um die erforderliche Anzahl von Bindungen zu bilden, daher muss eines der 2s2-Paare in das leere 2pz-Orbital befördert werden. Dies ist genau das gleiche wie immer, wenn Kohlenstoff Bindungen bildet – was auch immer es sonst noch verbindet.
Das Kohlenstoffatom befindet sich nun in einem angeregten Zustand.,
Hybridisierung
Bei Ethen besteht ein Unterschied zu Methan, da sich jeder Kohlenstoff nur mit drei statt mit vier Atomen verbindet. Wenn die Kohlenstoffatome ihre äußeren Orbitale hybridisieren, bevor sie Bindungen bilden,hybridisieren sie diesmal nur drei der Orbitale und nicht alle vier. Sie verwenden das 2s-Elektron und zwei der 2p-Elektronen, lassen aber das andere 2p-Elektron unverändert.