Electron-Konfigurasjonen
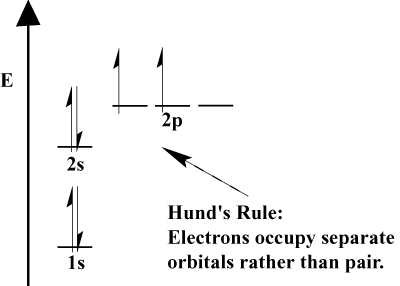
elektronene i et atom fylle opp sin atom-orbitals i henhold til Aufbau-Prinsippet; «Aufbau,» i tysk, betyr «å bygge opp.»Det Aufbau-Prinsippet, som inkorporerer Pauli Utelukkelse Prinsippet og Hund er Regelen foreskriver noen enkle regler for å avgjøre i hvilken rekkefølge elektroner fylle atomic orbitals:
- Elektroner fyll alltid orbitals av lavere energi først. 1s er fylt før 2s, og 2s før 2p.,
- Pauli Utelukkelse Prinsippet sier no to elektroner i en bestemt atom kan ha identisk quantum tall. I funksjonen, er dette prinsippet innebærer at dersom to elektroner okkupere samme orbital, de må ha motsatt spinn.
- Hunds Regel som sier at når et elektron blir et atom, og har til å velge mellom to eller flere orbitals av den samme energien, vil elektronet foretrekker å angi en tom orbital snarere enn en allerede opptatt., Som flere elektroner er lagt til atomer, disse elektronene har en tendens til halv fylle orbitals av den samme energien før sammenkobling med eksisterende elektroner til å fylle orbitals.
Valency og Valence Elektroner
Den ytterste orbital skall av et atom kalles sine valence shell, og elektroner i valence shell er valence elektroner. Valence elektroner er den høyeste energien elektronene i et atom, og er derfor den mest reaktive. Mens indre elektroner (de som ikke er i valence shell) som vanligvis ikke deltar i kjemiske bindinger og reaksjoner, valence elektroner kan være vunnet, tapt eller delt for å danne kjemiske bindinger., For denne grunn, elementer med samme nummer av valence elektroner har en tendens til å ha lignende kjemiske egenskaper, siden de har en tendens til å vinne, tape, eller dele valence elektroner på samme måte. Den Periodiske Tabellen ble utformet med tanke på dette har i tankene. Hvert element har en rekke valence elektroner lik sin gruppe nummer på den Periodiske Tabellen.
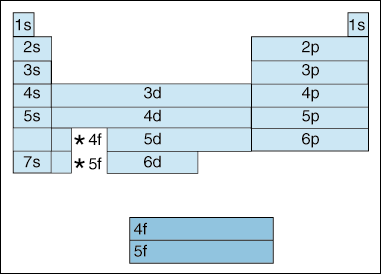
Denne tabellen viser en rekke interessante, og kompliserende, funksjoner av elektron konfigurasjonen.,
for det Første, som elektroner bli høyere i energi, et skifte finner sted. Opp til nå, vi har sagt at det som prinsipp quantum tall, øker, så gjør energi nivå av orbital. Og, som vi har nevnt ovenfor i Aufbau-prinsippet, elektroner fylle lavere energi orbitals før du fyller høyere energi orbitals. Men diagrammet ovenfor viser tydelig at det 4s orbital er fylt før 3d-orbital., Med andre ord, når vi kommer til prinsippet quantum nummer 3, den høyeste subshells av lavere quantum tall i eclipse energy lavest subshells av høyere quantum tall: 3d er av høyere energi enn 4s.
Andre, ovenfor angir en metode for å beskrive et element i henhold til electron-konfigurasjonen. Som du beveger deg fra venstre til høyre på tvers av den periodiske tabellen, skjemaet ovenfor viser i hvilken rekkefølge orbitals er fylt. Hvis vi var faktisk bryte ned skjemaet ovenfor i grupper heller enn blokkene vi har, ville det viser hvor nøyaktig hvor mange elektroner hvert element har., For eksempel, det element av hydrogen, som ligger i øverste venstre hjørne av den periodiske tabellen, er beskrevet som 1s1, med s beskriver som orbital inneholder elektroner og 1 beskriver hvor mange elektroner ligge i at orbital. Litium, som ligger på den periodiske tabellen nedenfor, hydrogen, ville bli beskrevet som 1s22s1. Elektronet konfigurasjoner av de første ti elementer er vist nedenfor (merk at valence elektroner er elektronet i høyeste energi shell, ikke bare elektronene i den høyeste energien subshell).,

De Octet Regel
Vår diskusjon av valence electron konfigurasjoner fører oss til en av kardinal prinsippene for kjemiske bindinger, den octet-regelen. Den octet-regelen sier at atomene becomeespecially stabil når deres valence skjell få en full utfylle av valence elektroner. For eksempel, i ovenfor, Helium (he) og Neon (Ne) har ytre valence skjell som er helt fylt opp, så ingen har en tendens til å få eller miste elektroner., Derfor, Helium og Neon, to av de såkalte Edle gasser, finnes i gratis atomic form og vanligvis ikke danne kjemiske bindinger med andre atomer.
de Fleste elementer, men ikke har en full ytre skall, og er for ustabilt til å eksistere som gratis atomer. I stedet søker de å fylle sine ytre electron skjell ved å danne kjemiske bindinger med andre atomer og dermed oppnå Edle Gass-konfigurasjon. Et element har en tendens til å ta den korteste veien til å oppnå Edle Gass konfigurasjon, enten det betyr å få eller å miste ett elektron., For eksempel, natrium (Na), som har ett elektron i sitt ytterste 3s orbital, kan miste denne electron å oppnå den electron-konfigurasjonen av neon. Klor, med syv valence elektroner, kan få et elektron til å oppnå konfigurasjonen av argon. Når to ulike elementer som har samme electron-konfigurasjonen, de kalles isoelectronic.
Diamagnetisme og Paramagnetisme
Den electron-konfigurasjonen av et atom har også konsekvenser på sin atferd i forhold til magnetisk felt. Slik atferd er avhengig av antall elektroner et atom har som spinn sammenkoblet., Husk at Hunds Regel og Pauli Utelukkelse Prinsippet kombineres for å tilsier at et atom er orbitals vil alle halv-fyll før du begynner å fullstendig fylle, og at når de helt fylle med to elektroner, disse to elektroner vil ha motsatt spinn.
Et atom med alle sine orbitals fylt, og derfor alle sine elektroner sammen med et elektron av motsatt spinn, vil være svært lite påvirket av magnetiske felt. Slike atomer kalles diagmetic. I motsatt fall, paramagnetiske ikke atomene har alle sine elektroner spinner-paret og er påvirket av magnetiske felt., Det er grader av paramagnetisme, siden et atom har kanskje en gruppert electron, eller det kan ha fire.