Innledning
Adipose-avledet stromal celler (ASCs) er multipotent og immunoprivileged, noe som gjør dem ideelle kandidater for terapeutiske formål (Bourin et al., 2013; Ma et al., 2014; Kallmeyer og Pepper, 2015). ASCs kan bli isolert ved hjelp av minimalt invasive teknikker fra ulike fettvev depoter i kroppen (Zuk et al., 2001)., De er preget av sin evne til å forholde seg til plast, en unik overflate markør profil og kapasitet til å differensiere i bein, fett og brusk (Dominici et al., 2006; Bourin et al., 2013). ASCs består ~15-30% av stromal vaskulær brøkdel (SVF) av fettvev (Bourin et al., 2013; Zuk, 2013), og må utvides ex vivo for å oppnå tilstrekkelig celle tall for terapeutiske formål.,
Gi trygge og regulerte celle terapi produkter til pasienter krever tilslutning til good manufacturing practices (GMP), og GMP retningslinjer skal følges gjennom hele prosessen med å isolere, utvide og skille ASCs (Giancola et al., 2012). De mange reagenser som brukes til å isolere og utvide ASCs for forskningsformål er dyr-avledet eller er ikke av klinisk-klasse, derfor, disse må byttes ut med mer passende alternativer i henhold til GMP-standarder (Halme og Kessler, 2006; Riis et al., 2015)., Vi går gjennom valg av serum tilskudd som kan brukes for ASC-utvidelsen i stedet for føtalt bovint serum (FBS), og beskrive deres effekter in vitro og in vivo som er rapportert i litteraturen.,
International Society of Cellular Terapi (ISCT) og Internasjonale Fett Anvendt Teknologi Samfunnet (IFATS) Retningslinjer og Teknikker som Brukes til å Vurdere Adipose-Avledet Stromal Celle Egenskaper
Et sett med minimal kriterier og retningslinjer som har blitt anbefalt av International Society of Cellular Terapi (ISCT) og Internasjonale Fett Anvendt Teknologi Samfunnet (IFATS) for karakterisering av ASCs (Dominici et al., 2006; Bourin et al., 2013)., Disse kriteriene omfatter evne til ASCs å forholde seg til plast, deres overflate markør profil og deres trilineage differensiering potensial. Den siste posisjonen papir som beskriver levedyktighet og spredning som ytterligere målinger til den opprinnelige karakterisering kriterier. Videre, eksperimentelle metoder og analyser som har blitt definert for å måle karakterisering kriterier (Bourin et al., 2013)., Disse kriteriene har vist seg å være påvirket av en rekke faktorer, for eksempel fettsuging teknikk, SVF isolasjon teknikk og media og tilskudd brukes under utvidelse prosessen (Koellensperger et al., 2014; Bajek et al., 2015; Busser et al., 2015). I henhold til ISCT og IFATS retningslinjer, det er anbefalt og godkjent forskning praksis for å bekrefte tilslutning til ovennevnte retningslinjer for hver isolasjon og kultur tilstand for å klassifisere den resulterende celle befolkningen som ASCs.,
Teknikker og Metoder som Brukes for å Karakterisere ASCs
Morfologi og Overholdelse
Når lastet tilhenger ASCs vise en tydelig morfologi, som kan beskrives som tynn, langstrakt og spindel-formet. Den morfologiske vurdering av ASCs er vanligvis utført ved hjelp av lys-mikroskopi (Trojahn Kølle et al., 2013).
Spredning
ISCT og IFATS retningslinjer har anbefalt at spredning og frekvens av stamfar ACSs er målt ved en fibroblastoid koloni-forming enhet analyse (Bourin et al., 2013)., Andre teknikker brukt i studiene referert i denne gjennomgangen gjøre bruk av telling levedyktige celler eller måling av proliferativ kapasitet på ASCs ved hjelp av immunohistochemistry. Telling metoder omfatter (1) telle celler ved hjelp av en levedyktighet fargestoff og en hemocytometer, (2) telle celler ved hjelp av enten telle perler eller flekker teknikker og flowcytometrisk analyse, og (3) ved hjelp av kolorimetrisk analyser som måler levedyktige celler i et spektrofotometer (Gharibi og Hughes, 2012; Trojahn Kølle et al., 2013; Bogdanova et al., 2014; Atashi et al., 2015; Johal et al., 2015; Oikonomopoulos et al., 2015).,
Immunophenotype
ISCT og IFATS retningslinjene har listet opp de uttrykk for flere overflate markører og forventet prosenter som et fast krav i stillingen sin uttalelse. De har også anbefalt at overflaten markør uttrykk bør måles ved multi-farge-antistoff farging (Bourin et al., 2013). Studier i denne gjennomgangen gjort bruk av flowcytometrisk analyse for å måle overflaten markør uttrykk (Müller et al., 2006; Lindroos et al., 2009; Chieregato et al., 2011; Josh et al., 2012; Trojahn Kølle et al., 2013; Bogdanova et al., 2014; Patrikoski et al., 2014).,
Trilineage Differensiering
Differensiering i adipose, bein og brusk har tradisjonelt blitt målt ved hjelp av histochemical flekker teknikker visualisert under mikroskopi, men ISCT og IFATS retningslinjer har anbefalt at kvalitative vurderinger bør bli erstattet eller supplert med kvantitative tilnærminger som måler avstamning-spesifikke mRNA uttrykk ved hjelp av revers transkripsjon kvantitative polymerase chain reaction (RT-qPCR) teknikker (Bourin et al., 2013)., Teknikker som har blitt brukt til å måle differensiering kapasitet, som er beskrevet i studiene referert i denne gjennomgangen, har variert fra histochemical flekker, til konvensjonell PCR og RT-qPCR. Histochemical flekker teknikker inkluderer farging av celler med enten (1) olje rød O og nilen rødt for adipogenesis; (2) Alizarin red S, alkalisk fosfatase og von Kossa for osteogenesis; eller (3) Alcian blå og safranin for chondrogenesis (Müller et al., 2006; Kocaoemer et al., 2007; Hebert et al., 2010; Rajala et al., 2010; Koellensperger et al., 2014; Oikonomopoulos et al., 2015; Riis et al., 2016).,
Serum Tilskudd
Føtalt Bovint Serum
FBS er den tradisjonelle serum supplement brukt til cellekultur. FBS inneholder vekstfaktorer (GFs) og andre elementer som er viktig for ASC vedlegg, utvidelse, vedlikehold og spredning in vitro (Lennon et al., 1995, 1996; Zuk et al., 2001; van der Valk et al., 2010). FBS er utsatt for batch til batch variasjon, xenoimmunization, og mulig kontaminering med mycoplasma, virus, endotoxins, og prioner (van der Valk et al., 2004, 2010; Chieregato et al., 2011; Kyllonen et al., 2013; Jin et al., 2015)., Kilden og kvalitet av FBS kan påvirke spredning og differensiering av ASCs, og rutinemessig screening for mycoplasma, endotoxins og virus har blitt viktig (Naaijkens et al., 2012). Disse faktorene kan påvirke eksperimentelle resultater og gjengi celle produktet utrygt for klinisk bruk (Zuk et al., 2001; van der Valk et al., 2004; Witzeneder et al., 2013).
ASCs er immunoprivileged, mangler uttrykk for major histocompatibility complex klasse II, samt T-og B-celle costimulatory molekyler (CD80, CD86, og CD40)., In vitro-immunogenicity og immunsuppressive egenskaper av ASCs er vanligvis målt ved co-å dyrke ASCs med perifert blod mononukleære celler i blandet lymfocytt reaksjoner og måling av T-celle-proliferativ svar (McIntosh et al., 2006; Patrikoski et al., 2014). ASCs demonstrere immunmodulerende og immunsuppressive egenskaper, som demonstrert ved sin evne til å regulere T-celle funksjon og modulere cytokin sekresjon in vitro og in vivo (Leto Barone et al., 2013; Roemeling-van Rhijn et al., 2013; Patrikoski et al., 2014)., Disse egenskapene oppstår fra lave immunogenicity av ASCs. De fleste av ASC og andre mesenchymal stem cell (MSC) kliniske studier (fase i, II, og III) bruk FBS supplert media, og det har blitt rapportert at immunogenic virkninger er som fremkalles av komponenter av FBS i menneskelige motiver (Sundin et al., 2007; Riis et al., 2015). For eksempel, en klinisk studie med bein marg-avledet MSCs (BM-MSCs) utvidet i FBS funnet antistoffer mot komponenter av FBS (Horwitz et al., 2002)., Immunsystemet til FBS som Arthus-og anafylaktiske reaksjoner er rapportert i kliniske studier, hvor pasienter ble behandlet med dendrittiske celler og lymfocytter utsatt for FBS (Selvaggi et al., 1997; Mackensen et al., 2000). I motsetning, en meta-analyse av MSC kliniske studier funnet at over 75% av eksperimenter brukt FBS i sin celle utvidelse protokoller og bare én studie overvåket og viste bivirkninger til FBS (Lalu et al., 2012)., In vivo studier som undersøker immunrespons av mus for å ASCs viste bevart immunsuppresjon og immunomodulation, lave immunogenicity, og ingen reaksjon til FBS (Cho et al., 2009; González et al., 2009). Selv om ASCs blir grundig testet i kliniske studier, deres definitive bruk som en terapeutisk agent gjenstår å bli etablert. Dette er ytterligere forsterket ved bruk av prekliniske modeller som kan være biologisk relevant (Monsarrat et al., 2016). Videre FBS kan være mindre immunogenic i mus og andre dyr modeller enn i mennesker., Til slutt, immunrespons som fremkalles av FBS (Selvaggi et al., 1997; Mackensen et al. I 2000; Horwitz et al., 2002) kunne tenkes å påvirke avstøtning av transplanterte cellene i celle-basert terapi.
Serum-Gratis Alternativer
Det ukjente og udefinert sammensetning av FBS er en stor ulempe. Et foretrukket alternativ ville være en kjemisk definerte medium med kjent sammensetning som kommersielt tilgjengelig serum-gratis (SF) eller XF media (Usta et al., 2014)., Disse serum-frie medier er feilaktig antatt å være blottet for noen animalske produkter, siden vilkårene SF og XF er ofte brukt om hverandre. Imidlertid, SF media er vanligvis supplert med dyr-avledet eller humant serum albumin og GFs i udefinert beløp (Patrikoski et al., 2013). Xeno-frie medier, på den annen side, er kjemisk definerte medier som inneholder godt definerte komponenter til bestemte konsentrasjoner (Usta et al., 2014).
vekstfaktorer
et Annet alternativ er å serum er tillegg av GFs til kultur medium, enten alene, eller som en cocktail., Disse GFs kan være syntetiske, dyr-stammer, eller human-avledet. Erstatning med syntetiske GFs er å foretrekke på grunn av sin høyere kvalitet og som et resultat av standardisering mellom partiene, som ikke kan være mulig for dyr – eller human-avledet GFs. Vanligvis brukes GFs er fibroblast growth factor, epidermal growth factor og platelet-avledet vekstfaktor (PDGF; Baer og Geiger, 2012; Ahearne et al., 2014). Tillegg av GFs har vært knyttet til en økning i spredning (Hebert et al., 2010; Gharibi og Hughes, 2012)., En forbedret adipogenic differensiering potensiale har tidligere blitt rapportert i ASCs utvidet i GF supplert medium (Hebert et al., 2010). En annen studie observert en negativ effekt på adipogenic og osteogenic differensiering i langsiktige kultivert ASCs (Gharibi og Hughes, 2012).
Serum Albumin
Serum albumin er et rikt plasma protein og kan være isolert fra mennesker og dyr. Ofte SF media er supplert med serum-albumin., Studier som sammenlignet humant serum albumin for ASC media tilskudd har funnet bedre spredning, en mindre spindel-som morfologi og bevart differensiering i adipose, bein og brusk (Rajala et al., 2010; Johal et al., 2015).
Kjemisk Definerte XF Medium
Xeno-gratis medium har blitt anbefalt som en erstatning for FBS og serum, som det inneholder de nødvendige komponenter for ASC ekspansjon, ikke innebærer giver eller batch til batch-variant, er GMP-kompatibel og har minimal immunogenicity og gunstige immunsuppresjon (van der Valk et al., 2004, 2010; Usta et al.,, 2014). Sammenlignet med FBS, bruk av XF medium for utvidelse av ASCs har ført til bedre morfologiske kvalitet, økt spredning, en sammenlignbar immunophenotype og differensiering i adipose, bein og brusk (Lindroos et al., 2009; Patrikoski et al., 2013; Oikonomopoulos et al., 2015). Bruk av XF media i ASC utvidelse resultater i ASCs å miste sin evne til å forholde seg til plast (Kyllonen et al., 2013; Patrikoski et al., 2013; Oikonomopoulos et al., 2015). Ytterligere belegg agenter er nødvendig for å opprettholde den iboende egenskap av plast-tilslutning forbundet med ASCs., Kommersielt tilgjengelig XF medium er dyrt og forbereder seg på i-house XF medium kan være tidkrevende og kan øke risikoen for batch til batch variasjon (Lund et al., 2009; Baer et al., 2010; Rajala et al., 2010; Yang et al., 2012; Kyllonen et al., 2013; Patrikoski et al., 2013; Oikonomopoulos et al., 2015).
Menneskelige Alternativer
Menneskelige alternativer som kan erstatte FBS og SF/XF supplert medier og kan skape en kultur miljø som på en mer nøyaktig måte ligner det menneskelige miljøet (Azouna et al., 2012; Koellensperger et al., 2014)., Videre bruk av autologous produkter (utledet fra samme individ) obviates behovet for testing for smittsomme og andre sykdomsfremkallende agens.
Humant Serum
Etter at hele blod har fått lov til å koagulere i fravær av en antikoagulant og har vært sentrifugerte, serum er den resulterende likvide delen som ikke inneholder blodplater, hvite blodceller eller røde blodlegemer (Figur 1; Stedman, 2006). Humant serum (HS) kan enten være autologous (donor og mottaker er samme person) eller allogen (utledet fra mennesker som er forskjellige fra mottakeren)., Både autologous og allogen HS er overlegen til FBS (Stute et al., 2004; Bieback et al., 2009, 2012; Bernardo et al., 2011; Kyllonen et al., 2013; Patrikoski et al., 2013). ASCs utvidet i HS har større transcriptome stabilitet enn de som er utvidet i FBS, mens genene ansvarlige for celle syklus forlengelse, differensiering og ekstracellulære matrix og prostaglandinsyntesen er oppregulert og overexpressed i FBS sammenlignet med HS ved hjelp av microarray analyse (Shahdadfar et al., 2005)., ASCs utvidet i FBS nådd senescence før og vises telomere forkorte sammenlignet med ASCs utvidet i HS (Shahdadfar et al., 2005). Valg av HS ser ut til å ha liten effekt på den immunmodulerende egenskaper av ASCs. ASCs utvidet i enten allogen HS eller FBS som inneholder media hadde lave immunogenicity og resulterte i immunsuppresjon (Patrikoski et al., 2014). ASCs utvidet i enten autologous eller allogen HS vise større spredning og et formidabelt immunophenotype sammenlignet med ASCs utvidet i FBS (Josh et al., 2012; Bogdanova et al., 2014)., ASCs utvidet i allogen HS har vært differensiert i adipose, bein og brusk, selv om den upregulation av chondrogenic og osteogenic gener ble favorisert i forhold til FBS (Josh et al., 2012). ASCs utvidet i autologous HS har vært differensiert i adipose og brusk, men evnen til å differensiere i bein var mindre favoriserte (Bogdanova et al., 2014). Autologous HS kan gi ASCs med bedre spredning og genomisk stabilitet som bestemmes av microarray analyse sammenlignet med allogen HS (Shahdadfar et al., 2005; Bieback et al., 2009; Bernardo et al., 2011)., ASCs utvidet i allogen HS angitt vekst arrest og gjennomgikk celledød (Shahdadfar et al., 2005; Lindroos et al., 2009), noe som begrenser den potensielle fordeler av allogen HS. Mens autologous HS kan være ideelt, tilgjengeligheten er begrenset og det kan være betydelig variasjon mellom pasienter på muligheten av sine egne serum for å støtte veksten av sine egne celler (Lange et al., 2007). Alternativt, allogen HS kan være samlet, noe som gir større mengder laboratorium for eksperimentering og kan gjennomgå grundig kvalitet testing av blod bank (f.eks., å teste for fravær av smittsomme sykdommer og forurensning med andre blodlegemer) før bruk i mennesker (Bieback et al., 2009).
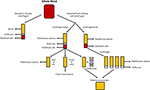
Figur 1. Produksjon av ulike menneskelige alternativer. Serum er produsert når hele blod er lov til å koagulere og sentrifugerte å pellet røde og hvite blodlegemer, og blodplater. Plasma er produsert av forebygging av clotting etterfulgt av sentrifugering., Avhengig av sentrifugering hastighet, enten platederivert dårlig plasma (PPP; rask sentrifugering), eller blodplater rike plasma (PRP; tregere sentrifugering) er produsert. Hvis PPP lagres ved -18°C det er kjent som frisk frosset plasma. Platederivert konsentrater kan produseres enten ved å ta platederivert dårlig plasma og 4 buffy strøk og samle dem sammen eller sentrifugering flere PRP ‘ s og sammenslåing av blodplater pellets (suspendert i en liten mengde av plasma) sammen.,
Plasma
Plasma er det ikke-cellulær likvide delen av blodet som inneholder vann, elektrolytter og proteiner (koagulasjonsfaktorer, fibrinogen, og antikoagulantia). Platederivert dårlig plasma (PPP), frisk frosset plasma (leveres normalt ut), og platelet rich plasma (PRP; Figur 1) kan fås fra helblod ved sentrifugering ved forskjellige hastigheter, og påfølgende lagring ved forskjellige temperaturer. GF sekresjon kan bli styrket ved aktivering av blodplater i hele blod med trombin før sentrifugering (Doucet et al., 2005; Kocaoemer et al.,, 2007), og dermed øke aktiviteten i plasma produkter.
Platederivert Dårlig Plasma
PPP er nesten gratis av blodplater og er produsert fra helblod ved tillegg av en antikoagulant under samlingen prosessen, etter som plasma skilles ved hjelp av rask sentrifugering (Figur 1; Koellensperger et al., 2006). Dette gjør at blodplater og røde blodceller til å være pelletert. Den resulterende PPP er lagret ved 4°C og er referert til som frisk plasma., PDGF er utskilt ved å samle blodplater, men ubetydelig PDGF er utgitt i PPP som et resultat av lite antall gjenværende blodplater. GFs kan dermed trenger å bli lagt til PPP når det brukes i media som er tilfelle ved bruk av SF medium (Müller et al., 2006; Gottipamula et al., 2013). Ved hjelp av PPP-uten tillegg av GFs har resultert i lavere spredning priser og en mindre økning i DNA-syntese som måles ved hjelp av thymidine inkorporering, sammenlignet med HS og FBS (Vogel et al. I 1980; Koellensperger et al., 2006)., PPP med ekstra GFs resultert i økt spredning priser i forhold til HS (Koellensperger et al., 2006), men disse forskjellene kan ha oppstått fra forskjellige produksjons-protokoller av KKP og tillegg av varierende nivåer av GFs til hver av PPP-preparater i denne studien. Utvidelse av ASCs i PPP resulterer i forbedret spredning sammenlignet med FBS, og har osteogenic differensiering som er sammenlignbar med ASCs utvidet i HS (Koellensperger et al., 2014)., Chondrogenic differensiering ble redusert i ASCs utvidet i PPP sammenlignet med ASCs utvidet i PRP (Koellensperger et al., 2014).
Frisk Frosset Plasma
leveres normalt ut er innhentet på samme måte som PPP, men det er frosset direkte etter separasjon ved -18°C (O’Shaughnessy et al., 2004; Liumbruno et al., 2009). Leveres normalt ut, har vært brukt i utvidelsen av BM-MSCs med positive resultater., Disse resultatene inkluderer bedre spredning, immunsuppressive aktivitet, og differensiering i adipocytter og osteocytes, og en immunophenotype og morfologi som er sammenlignbare med celler utvidet i FBS (Müller et al., 2006; Mannello og Tonti, 2007). Imidlertid er bruken av leveres normalt ut som et serum erstatning i ASC utvidelse krever videre undersøkelser.
Platelet Rich Plasma
» PRP » er del av blodet som er beriket i antall blodplater. PRP er produsert ved å skille plasma fra røde blodceller ved langsommere sentrifugering hastigheter, noe som hindrer pelletering av blodplater (Figur 1)., ASCs utvidet i PRP opprettholde en klassisk immunophenotype og morfologi, og PRP øker spredning sammenlignet med FBS (Kocaoemer et al., 2007; Chieregato et al., 2011; Atashi et al., 2015). ASCs utvidet i PRP har økt differensiering effektivitet mot adipogenic og osteogenic linjene, mens det å ha sammenlignbare effektivitet for chondrogenic differensiering, sammenlignet med ASCs utvidet i FBS (Kocaoemer et al., 2007; Chieregato et al., 2011). Når forhold, HS ble funnet å være litt bedre enn PRP i form av differensiering og spredning av ASCs (Kocaoemer et al.,, 2007; Chieregato et al., 2011). PRP er en dårlig definert kultur medium supplement på grunn av sin høye biologiske variasjon og komplisert utvinning prosedyre, som å rense blodplate faktor-rik supernatant fra plasma membraner kan være vanskelig. Bruk av PRP er begrenset av store mengder av hele blod som trengs for å gi nok PRP for eksperimentering (Chieregato et al., 2011).,
Platederivert Lysate
Human platelet lysate (HPL) inneholder blodplater GFs som er oppnådd ved lysing blodplater konsentrert i et lite volum av plasma (platelet konsentrater; Figur 1) ved temperatursvingninger. HPL inneholder en høyere konsentrasjon av GFs enn andre serum erstatter inkludert menneskelige PRP og FBS (Doucet et al., 2005; Bernardo et al., 2006, 2011; Bieback et al., 2009; Schallmoser et al., 2010)., HPL kan lett bli innhentet og produsert fra aferese produkter og buffy strøk, og kan være resuspendert i enten PRP eller en additiv løsning (Schallmoser og Strunk, 2013; Iudicone et al., 2014). HPL er produsert ved å fryse blodplater på mellom -30 og -80°C i 24 timer, etterfulgt av en tining og sentrifugering. Gjentatte fryse, tine og sentrifuger sykluser tillate for utgivelsen av GFs og fjerning av blodplater organer (Bernardo et al., 2006; Schallmoser et al., 2007)., En annen fordel av HPL tilskudd er at blodplater kan brukes etter 4-5 dagers utløpsdatoen av samlet blod (Bieback et al., 2009). HPL er et bedre alternativ enn autologous og allogen HS, som ASCs utvidet i HPL opprettholde sin klassiske immunophenotype, differensiering, clonogenic effektivitet, celle renhet, og celleviabilitet (Trojahn Kølle et al., 2013; Riis et al., 2016). HPL støtter også langsiktig utvidelse uten at det går ut over immunmodulerende egenskaper av ASCs, målt ved flowcytometrisk analyse (Bieback et al., 2009)., Ekspansjon i HPL resultater i en kortere befolkningen dobling tid, redusere tiden som kreves for celle vekst og redusere trusselen om senescence og transformasjon (Doucet et al., 2005; Shahdadfar et al., 2005; Bernardo et al., 2006, 2011; Azouna et al., 2012). Bio-safety av HPL har vært vurdert ved hjelp av array komparativ genomisk hybridisering og høy spektral følsomhet karyotyping, hvor det ble funnet at ASCs utvidet i HPL hadde ingen kromosomale avvik (Crespo-diaz et al., 2011; Trojahn Kølle et al., 2013)., Klassisk ASC morfologi (tynne, små, avlange, og spindel-formet) opprettholdes i HS og HPL, mens ASCs utvidet i FBS er større og mindre spindel-formet (Trojahn Kølle et al., 2013). Selv om dette kan tyde på at både HS og HPL-velg for primitive/umodne ASCs (Doucet et al., 2005; Bieback et al., 2009), er det antyder også at celler dyrket i FBS har redusert spredning og utvikle seg raskere mot senescence. HPL varierer mellom individer (Bernardo et al., 2006; Crespo-diaz et al., 2011), og batch til batch variasjon er redusert når HPL er samlet (Schallmoser et al.,, 2007; Trojahn Kølle et al., 2013). Videre, ved å samle mange givere, en stor mengde kan være innhentet for tilskudd, noe som gjør HPL foretrekke å PRP (Kocaoemer et al., 2007; Bieback et al., 2009; Chieregato et al., 2011).
Konklusjon
Ifølge for å Riis et al. av alle registrerte kliniske forsøk med utvidet ASCs som har listet opp sine utvidelse betingelser, de fleste gjør bruk av FBS, tre studier bruke autologous HS, en studie bruker PRP, og en studie bruker HPL (Riis et al., 2015)., Denne statistikken er alarmerende, som FBS har potensial til å overføre zoonotic sykdommer følgende cellen transplantasjon, og immunologiske reaksjoner mot FBS komponenter har blitt rapportert (Selvaggi et al., 1997; Mackensen et al., 2000). FBS er en ikke-GMP-kompatibelt produkt, som det påvirker sikkerhet og effekt av ASC terapeutisk, og dermed må byttes ut (van der Valk et al., 2004; Kyllonen et al., 2013; Witzeneder et al., 2013). Dette har vært løst ved å bytte ut FBS med kjemisk definerte menneskelig avledet alternativer., Endring fra FBS til menneskelig alternativer eller XF/SF media i regenerativ medisin har den viktige fordelen at den ASCs spre seg mye raskere i det siste, noe som resulterer i et større antall celler for transplantasjon i en kortere tid. Men den relative overlegenhet av forskjellige kultur-media er fortsatt mye debattert. Studier som sammenligner mer enn én kultur medium har rapportert om varierende resultater (Lange et al., 2007; Bernardo et al., 2011; Koellensperger et al., 2014; Riis et al., 2016). Koellensperger et al., sammenlignet trilineage differensiering av ASCs utvidet i FBS, PRP, PPP, og HS (Koellensperger et al., 2014). Deres resultater viste at hver kultur medium tillatt differensiering i en eller flere linjer, men aldri i alle de tre linjene. Når XF media, FBS og HPL supplert media ble sammenlignet, Riis et al. funnet ut at visse undergrupper av befolkningen uttrykk for bestemte overflaten markører avhengig av kultur medium utnyttet (Riis et al., 2016)., Studier å sammenligne immunophenotype av ASCs utvidet i FBS og andre kultur, media, finnes det liten eller ingen forskjell i celleoverflaten markør uttrykk, uavhengig av markører undersøkt (Tabell 1). Seeding tetthet, oksygen-spenning, confluency, dissosiasjon, og valg av basal media kan også påvirke eksperimentelle resultater (Sotiropoulou et al., 2006; Freshney, 2010; Bourin et al., 2013; Inamdar og Inamdar, 2013; Feng et al., 2014; Riis et al., 2015)., Valg av kultur medium avhenger nedstrøms anvendelse av disse cellene (administrasjon av differensiert eller ikke-differensiert ASCs) og den tilstanden som behandles. I tillegg immunogenicity av kultur-mediet som brukes til å utvide celler før kliniske programmet bør betraktes som et parameter som kan påvirke det kliniske resultatet. De fleste studier som sammenligner ulike kultur-media som brukes kriteriene som er angitt av ISCT og IFATS å validere bruk av et alternativ til FBS., De fleste av disse studiene undersøke ASC morfologi, spredning, immunophenotype, og evnen til disse cellene å skille langs osteogenic, chondrogenic, og adipogenic linjene i ulike kultur-media. Få studier har utforsket andre aspekter av ASCs, for eksempel senescence, genetisk stabilitet, transcriptome, proteome, immunogenicity, cytokin sekret, og celle syklus (Shahdadfar et al., 2005; Bieback et al., 2012). Mens ISCT og IFATS kriterier var et forsøk på å forene feltet i form av standard operating procedures (Dominici et al., 2006; Bourin et al.,, 2013), er det ingen konsensus som eksisterer rundt hvilke egenskaper av ASCs er relevant for kliniske studier, noe som gjør sammenligning av forskjellige kultur-media praktisk talt umulig. Mens disse kriteriene gir målbare resultater for enkel sammenligning, endre komponenter som brukes til utvidelse av ASCs kan ha ulike effekter på sikkerhet, effektivitet og reproduserbarheten av ASC end produkter. Å undersøke endringer i transcriptome, proteome, og secretome av ASCs utvidet i ulike kultur medier er viktig, så er det bruk av celler utvidet under varierende forhold i aktuelle prekliniske modeller.,

Tabell 1. Effekten av de ulike mediene kosttilskudd på ASCs in vitro.
Forfatter Bidrag
CD begrepsfestet og skrevet anmeldelsen, og godkjent det siste manuskriptet. MP bistått i konseptualisering av gjennomgangen, revidert og godkjent i det siste manuskriptet. MSP-assistert i konseptualisering av gjennomgangen, redigert og godkjent i det siste manuskriptet, og hevet finansiering for prosjekter bekymret. Alle forfatterne har lest og godkjent det siste manuskriptet.,
Midler
Denne forskningen og publiseringen av dette er resultatet av midler gitt av Medical Research Council i Sør-Afrika i form av (a) MRC er Flaggskipene Awards Prosjektet SAMRC-RFA-UFSP-01-2013/STILK CELLER, så vel som (b) Extramural Enhet for Stilk Cellen Forskning og Terapi. National Research Foundation i Sør-Afrika også gitt midler.
interessekonflikt Uttalelse
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller finansielle forhold som kan oppfattes som en potensiell interessekonflikt.,
Erkjennelsene
forfatterne ønsker å takke Dr. Cheryl Tosh for henne redaksjonell assistanse.
Chieregato, K., Castegnaro, S., Madeo, D., Astori, G., Pegoraro, M., og Rodeghiero, F. (2011). Epidermal growth factor, grunnleggende fibroblast growth factor og platelet-avledet growth factor-bb kan erstatte føtalt bovint serum og konkurrere med humane blodplater rike plasma i ex vivo utvidelse av mesenchymal stromal celler avledet fra fettvev. Cytotherapy 13, 933-943. doi: 10.3109/14653249.2011.,583232
PubMed Abstrakt | CrossRef Full Tekst | Google Scholar
Mannello, F., og Tonti, G. (2007). Kortfattet gjennomgang: ingen gjennombrudd for menneskelig mesenchymal og embryonale stamcellene kultur: kondisjonert medium, mater lag, eller mater gratis; medium med føtalt kalveserum, humant serum, eller beriket plasma; serum-gratis, serum erstatning nonconditioned medium, eller ad hoc-formelen? alt som glitrer er ikke gull! Stamceller 25, 1603-1609. doi: 10.1634/stemcells.2007-0127
PubMed Abstrakt | CrossRef Full Tekst | Google Scholar
Selvaggi, T. A., Walker, R. E., og Fleisher, T. A. (1997). Utvikling av antistoffer mot føtalt kalveserum med arthus-lignende reaksjoner i human immunodeficiency virus-infiserte pasienter gitt syngeneic lymfocytt infusjoner. Blod 89, 776-779.
PubMed Abstrakt | Google Scholar
Stedman, T. L. (2006). Stedman ‘ s Medisinsk Ordbok. Philadelphia, PA: Lippincott Williams & Wilkins.
Google Scholar