Hvordan virker en buffer arbeid?
En buffer er i stand til å motstå pH-endring, fordi de to komponentene (konjugat syre og kobling base) er begge til stede i betydelig beløp på likevekt og er i stand til å nøytralisere små mengder av andre syrer og baser (i form av H3O+ og OH-) når det er lagt til løsning. For å avklare denne effekten, kan vi vurdere den enkle eksempel på en fluorsyre (HF) og Natrium, Fluor (NaF) buffer., Fluorsyre er en svak syre på grunn av den sterke tiltrekningen mellom relativt liten F – ion og solvated protoner (H3O+), som ikke tillater det å distansere seg helt i vann. Derfor, hvis vi får tak i HF i en vandig løsning, kan vi fastslå følgende likevekt med bare liten dissosiasjon (Ka(HF) = 6.6×10-4, sterkt favoriserer reaktantene):
\
Vi kan da legge til og oppløse sodium fluorid i løsningen og bland de to til vi kommer ønsket volum og pH som vi ønsker å buffer., Når Sodium Fluorid oppløses i vann, reaksjonen går til ferdigstillelse, og dermed får vi:
\
Siden Na+ er konjugat av en sterk base, vil det ikke ha noen effekt på pH-eller reaktivitet av bufferen. Tillegg av \(NaF\) til løsning vil imidlertid øke konsentrasjonen av F – i buffer løsning, og følgelig av Le Chatelier ‘ s Prinsipp, føre til litt mindre dissosiasjon av HF i forrige likevekt, så vel. Tilstedeværelsen av store mengder av både konjugat syre, \(HF\), og konjugat base -, F-, som gir løsningen til å fungere som en buffer., Dette buffering handling kan sees i titrering kurve av en bufferløsning.
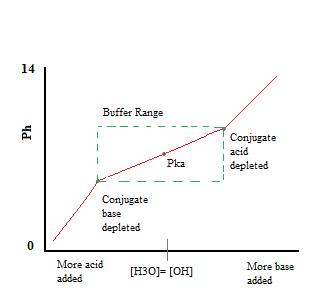
Som vi kan se, over arbeidsområdet i bufferen. pH endres svært lite med tillegg av syre eller base. Når buffering kapasiteten er overskredet hastighet på pH endres raskt hopp. Dette skjer fordi konjugat syre eller base har blitt utarmet gjennom nøytralisering. Dette prinsippet innebærer at en større mengde av konjugat syre eller base vil ha en større buffering kapasitet.,
Hvis syre var lagt til:
\
I denne reaksjonen, konjugat base -, F-, vil nøytralisere lagt syre, H3O+, og denne reaksjonen går til ferdigstillelse, fordi reaksjonen av F – med H3O+ har en likevekt konstant mye større enn én. (Faktisk, likevekt konstant reaksjonen som skrevet er akkurat det omvendte av Ka for HF: 1/Ka(HF) = 1/(6.6×10-4) = 1.5×10+3.,) Så lenge det er mer F – enn H3O+, nesten alle av H3O+ vil bli konsumert og likevekt vil skifte til høyre, litt økt konsentrasjon av HF og litt konsentrasjonen av F-, men noe som resulterer i nesten ingen endring i mengden av H3O+ stede når likevekt er re-etablert.,
Hvis base var lagt til:
\
I denne reaksjonen, konjugat syre, HF, vil nøytralisere lagt mengder base, OH-, og likevekt vil igjen skift til høyre, litt økt konsentrasjon av F – i løsningen og redusere mengden av HF litt. Igjen, siden de fleste av OH – er nøytralisert, lite pH-endring vil oppstå.
Disse to reaksjonene kan fortsette å veksle frem og tilbake med litt pH endring.